Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Mg+2HCl->MgCl2+H2
x x
2Al+6HCl->2AlCl3+3H2
y 3/2 y
mMg+mAl=23.4
->24x+27y=23.4
nH2=1.2(mol)
x+3/2 y=1.2
x=0.3(mol)->mMg=7.2(g)
y=0.6(mol)_>mAl=16.2(g)
Bạn tự tính % nhé :333
- Khối lượng không tan là Cu
\(\Rightarrow\) %Cu = \(\dfrac{20,48.100}{43,88}\) \(\approx\) 46,7%
\(\Rightarrow\) mhỗn hợp Mg và Al = 43,88 - 20,48 = 23,4 (g)
nH2 = 1,2 mol
Đặt nMg = x ( mol ); nAl = y ( mol ); ( x, y > 0 )
Mg + 2HCl \(\rightarrow\) MgCl2 + H2 (1)
2Al + 6HCl \(\rightarrow\) 2AlCl3 + 3H2 (2)
Từ (1)(2) ta có hệ pt
\(\left\{{}\begin{matrix}24x+27y=23,4\\x+1,5y=1,2\end{matrix}\right.\)
\(\Rightarrow\) \(\left\{{}\begin{matrix}x=0,3\\y=0,6\end{matrix}\right.\)
\(\Rightarrow\) %Mg = \(\dfrac{0,3.24.100}{43,88}\) \(\approx\) 16,4%
\(\Rightarrow\) %Al = \(\dfrac{0,6.27.100}{43,88}\) \(\approx\) 36,9%

PTHH:
Zn + H2SO4 ---> ZnSO4 + H2 (1)
2Al + 3H2SO4 ---> Al2(SO4)3 + 3H2 (2)
Ta có: \(n_{H_2}=\dfrac{1,792}{22,4}=0,08\left(mol\right)\)
Gọi x, y lần lượt là số mol của Zn và Al
a. Theo PT(1): \(n_{H_2}=n_{Zn}=x\left(mol\right)\)
Theo PT(2): \(n_{H_2}=\dfrac{3}{2}.n_{Al}=\dfrac{3}{2}y\left(mol\right)\)
=> \(x+\dfrac{3}{2}y=0,8\) (*)
Theo đề, ta có: 65x + 27y = 3,79 (**)
Từ (*) và (**), ta có HPT:
\(\left\{{}\begin{matrix}x+\dfrac{3}{2}y=0,8\\65x+27y=3,79\end{matrix}\right.\)
(Ra số âm, bn xem lại đề nhé.)

Gọi nNa = a, nAl=b trong 13,25g hh
=> 23a + 27b = 13,25 (l)
2Na + H2SO4 \(\rightarrow\) Na2SO4 + H2
a --------------------------------> 0,5a (mol)
2Al + 3H2SO4 \(\rightarrow\) Al2(SO4)3 + 3H2
b ------------------------------------> 1,5b (mol)
=> 0,5a + 1,5b = \(\frac{9,52}{22,4}\) = 0,425 (ll)
Từ (l) và (ll) => \(\begin{cases}a=0,4\\b=0,15\end{cases}\)
a) mNa = 0,4 . 23 = 9,2 (g)
mAl = 4,05 (g)
b) %mNa = \(\frac{9,2}{13,25}\) . 100% = 69,43%
%mAl= 30,57%

2Al + 6HCl → 2 A l C l 3 + 3 H 2
a……….3/2.a (mol)
Mg + 2HCl → M g C l 2 + H 2
b....................b (mol)
4 gam rắn không tan là Cu, gọi số mol của Al và Mg lần lượt là a và b (mol). Ta có:
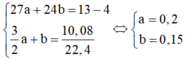
⇒ % m C u = 4 13 .100 = 30,77 % ⇒ % m A l = 0,2.27 13 .100 = 41,54 % ⇒ % m M g = 100 % − 30,77 % − 41,54 % = 27,69 %
⇒ Chọn C.

a. PTHH:
Fe + 2HCl ---> FeCl2 + H2 (1)
Mg + 2HCl ---> MgCl2 + H2 (2)
b. Gọi x, y lần lượt là số mol của Fe và Mg
Ta có: \(n_{H_2}=\dfrac{5,6}{22,4}=0,25\left(mol\right)\)
Theo PT(1): \(n_{H_2}=n_{Fe}=x\left(mol\right)\)
Theo PT(2): \(n_{H_2}=n_{Mg}=y\left(mol\right)\)
\(\Rightarrow x+y=0,25\) (*)
Theo đề, ta lại có: 56x + 24y = 8,25 (**)
Từ (*) và (**), ta có HPT:
\(\left\{{}\begin{matrix}x+y=0,25\\56x+24y=8,25\end{matrix}\right.\Leftrightarrow\left\{{}\begin{matrix}x\approx0,07\\y\approx0,18\end{matrix}\right.\)
=> \(m_{Fe}=0,07.56=3,92\left(g\right)\)
=> \(\%_{m_{Fe}}=\dfrac{3,92}{8,25}.100\%=47,52\%\)
\(\%_{m_{Mg}}=100\%-47,52\%=52,48\%\)

2Al + 3H2SO4 -> Al2(SO4)3 + 3H2 (1)
2 3 1 3 ( mol)
2x 3x x 3x
Mg + H2SO4 -> MgSO4 +H2 (2)
1 1 1 1
y y y y
Gọi số mol của Al là x
=> nAl = 2x, nH2SO4 = 3x, nAl2(SO4)3= x , nH2= 3x
Gọi số mol của Mg là y
=> nMg = y, nH2SO4 = y, nMgSO4 = y, nH2= y
Ta có:
mhh = mAl + mMg
1,41= 27.2x + 24y
1,41= 54x + 24y
V H2 (1) + V H2 (2) = 1,568 (1568ml = 1,568 l)
22,4 . 3x + 22,4y = 1,568
67,2x + 22.4y = 1,568
Có : - 54x + 24y=1,41
- 67,2x + 22.4y = 1,568
Bấm máy tính => x = 0,015
y = 0,025
mAl = 54x = 54 . 0,015 = 0,81 9(g)
mMg = 1,41 - 0,81 = 0,6 (g)
%mAl = 0,81 . 100 / 1,41 = 57,45%
%mMg = 100% - 57,45% = 42,55%

Ta có nH2 = 3,36/22,4 = 0,15 mol
Fe +2 HCl -> FeCl2 + H2
0,15. 0,3 <-. 0,15. ( Mol)
=> mFe = 0,15 × 56 = 8,4g
=> %Fe = 8,4/15×100% = 56%
=> %Cu = 100% - 56% = 44%
=>VHCl =1\0,3=10\3 l
Mg+2HCl->MgCl2+H2
x x
2Al+6HCl->2AlCl3+3H2
y 3/2 y
mMg+mAl=23.4
->24x+27y=23.4
nH2=1.2(mol)
x+3/2 y=1.2
x=0.3(mol)->mMg=7.2(g)
y=0.6(mol)_>mAl=16.2(g)
Bạn tự tính % nhé ^^