Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Gọi nAl = x (mol), nCu = y (mol); nNO2 = 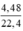 = 0,2 mol
= 0,2 mol
Theo pt: nNO2(1) = 3. nAl = 3.x mol
nNO2(2) = 2. nCu = 2y mol
⇒ Tổng nNO2 = 3x + 2y = 0,2 mol
Ta có hệ phương trình
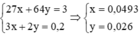
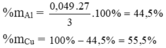

Gọi $n_{Cu} = a(mol) ; n_{Al} = b(mol) \Rightarrow 64a + 27b = 3(1)$
$Cu^0 \to Cu^{+2} + 2e$
$Al^0 \to Al^{+3} + 3e$
$N^{+5} + 1e \to N^{+4}$
Bảo toàn electron :
$2a + 3b = 0,2(2)$
Từ (1)(2) suy ra $a = \dfrac{3}{115} ; b = \dfrac{17}{345}$
\(\%m_{Cu}=\dfrac{\dfrac{3}{115}.64}{3}.100\%=55,65\%\\ \%m_{Al}=100\%-55,65\%=44,35\%\)
Gọi số mol của Cu và Al lần lượt là x,y (mol) (x,y>0)
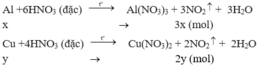
\(Cu+4HNO_{3\left(đ\right)}\underrightarrow{to}Cu\left(NO_3\right)_2+2NO_2+2H_2O\\ x..................................2x\left(mol\right)\\ Al+6HNO_{3\left(đ\right)}\underrightarrow{to}Al\left(NO_3\right)_3+3NO_2+3H_2O\\ y...............................3y\left(mol\right)\)
\(\left\{{}\begin{matrix}64x+27y=3\\2x+3y=0,2\end{matrix}\right.\Leftrightarrow\left\{{}\begin{matrix}x=\dfrac{3}{115}\\y=\dfrac{17}{345}\end{matrix}\right.\)
\(\left\{{}\begin{matrix}\%m_{Cu}=\dfrac{\dfrac{3}{115}.64}{3}.100\approx55,652\%\\\%m_{Al}\approx44,348\%\end{matrix}\right.\\ \)

a) nNO = 0,03 mol
Gọi số mol của Fe và Cu lần lượt là x, y ta có:
\(\left\{{}\begin{matrix}56x+64y=2,48\\3x+2y=0,03.3=0,09\end{matrix}\right.\) <=> \(\left\{{}\begin{matrix}x=0,01\\y=0,03\end{matrix}\right.\)
Suy ra: mFe = 0,56 g ; mCu = 1,92 g
b) nHNO3 = 4nNO = 0,12 mol => CM = 0,6 M
c) mmuối = mKL + 3nNO.62 = 8,06 (g)

Chất rắn không tan là Vàng $\Rightarrow m_{Au} = 1,97(gam)$
Gọi $n_{Cu} = a(mol) ; n_{Ag} = b(mol) \Rightarrow 64a + 108b = 6,05 - 1,97(1)$
$n_{NO_2} = \dfrac{1,792}{22,4} = 0,08(mol)$
Bảo toàn e : $2a + b = 0,08(2)$
Từ (1)(2) suy ra : a = 0,03 ; b = 0,02
$\%m_{Au} = \dfrac{1,97}{6,05}.100\% = 32,6\%$
$\%m_{Cu} = \dfrac{0,03.64}{6,05}.100\% = 31,7\%$
$\%m_{Ag} = 100\% - 32,6\% - 31,7\% = 36,7\%$

Gọi \(\left\{{}\begin{matrix}n_{C_6H_5OH}=a\left(mol\right)\\n_{CH_3OH}=b\left(mol\right)\end{matrix}\right.\left(đk:a,b>0\right)\)
\(n_{H_2}=\dfrac{3,36}{22,4}=0,15\left(mol\right)\)
PTHH:
\(C_6H_5OH+Na\rightarrow C_6H_5ONa+\dfrac{1}{2}H_2\)
a-------------------------------------->0,5a
\(CH_3OH+Na\rightarrow CH_3ONa+\dfrac{1}{2}H_2\)
b-------------------------------------->0,5b
Theo bài ra, ta có hệ: \(\left\{{}\begin{matrix}94a+32b=22\\0,5a+0,5b=0,15\end{matrix}\right.\)
\(\Leftrightarrow\left\{{}\begin{matrix}a=0,2\\b=0,1\end{matrix}\right.\left(TM\right)\) hay \(\left\{{}\begin{matrix}n_{C_6H_5OH}=0,2\left(mol\right)\\n_{CH_3OH}=0,1\left(mol\right)\end{matrix}\right.\)
\(\rightarrow\left\{{}\begin{matrix}\%m_{C_6H_5OH}=\dfrac{0,2.94}{22}.100\%=85,45\%\\\%m_{CH_3OH}=100\%-85,45\%=14,55\%\end{matrix}\right.\)
b) Trong 11 gam hỗn hợp có:
\(\left\{{}\begin{matrix}n_{C_6H_5OH}=\dfrac{11}{22}.0,2=0,1\left(mol\right)\\n_{CH_3OH}=\dfrac{11}{22}.0,1=0,05\left(mol\right)\end{matrix}\right.\)
PTHH: \(C_6H_5OH+3HNO_3\xrightarrow[H_2SO_4\left(đặc\right)]{}3H_2O+C_6H_2OH\left(NO_2\right)_3\)
0,1--------------------------------------------->0,1
\(\rightarrow m_{C_6H_2OH\left(NO_2\right)_3}=0,1.229=22,9\left(g\right)\)

Ta có: mNO3-= mmuối nitrat- mkim loại= (m+31)-m= 31 gam → nNO3-= 0,5 mol
Ta thấy số oxi hóa của Cu, Fe, Al trong muối nitrat và trong các oxit tương ứng là bằng nhau
→nNO3-= nđiện tích dương của cation= 2.nO2- → nO2-= 0,25 mol
→ moxit= mkim loại+ mO2-= m+ 0,25.16= m+ 4 (gam)
Đáp án C

\(C_3H_6 + H_2O \xrightarrow{t^o} CH_3-CH_2-CH_2OH\\ C_3H_6 + H_2O \xrightarrow{t^o} CH_3-CH(OH)-CH_3\\ CH_3-CH_2-CH_2-OH + CuO \xrightarrow{t^o} CH_3-CH_2-CHO + Cu + H_2O\\ CH_3-CH(OH)-CH_3 + CuO \xrightarrow{t^o} CH_3-CO-CH_3 + Cu + H_2O\\ CH_3-CH_2-CHO + Ag_2O \xrightarrow{NH_3} 2Ag + CH_3-CH_2-COOH\)
n Ag = 4,32/108 = 0,04(mol)
Theo PTHH :
n CH3CH2CHO = 1/2 n Ag = 0,02(mol)
n C3H6 = 2,24/22,4 = 0,1(mol)
=> n CH3COCH3 = 0,1 - 0,02 = 0,08(mol)
%m CH3CH2CHO = 0,02.58/(0,05.58 + 0,08.58) .100% = 20%
Đề bị thiếu rồi, em xem lại nha!