Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Số mol các chất và ion trong dung dịch muối ban đầu là:


Dung dịch X gồm ![]()
Chất rắn Y gồm 2 kim loại là Cu và Fe.
Dung dịch X tác dụng với dung dịch AgNO3 dư;
Phản ứng tạo kết tủa: 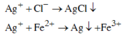
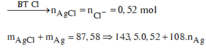
![]()
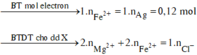
![]()
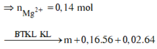
![]()
![]()
Đáp án C

Đáp án C
Ta có: ![]()
Ta có: ![]()
Bảo toàn điện tích:
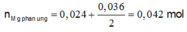
Do vậy rắn Z chứa 0,038 mol Mg dư.
BTKL: m = 4,826 - 0,038.24 + 4,21 - 0,036.108 - 0,024.64 = 2,7 gam

Chọn đáp án C
Tổng số mol anion trong dung dịch được bảo toàn là ∑ n NO 3 - mol.
Lượng các nguyên tố kim loại và thứ tự trong dãy điện hóa:
0,02 mol Al > 0,01 mol Fe > 0,4 mol Cu > 0,064 mol Ag.
→ dung dịch sau phản ứng chứa: 0,02 mol Al(NO3)3 + 0,01 mol Fe(NO3)2 + 0,392 mol Cu(NO3)2.
→ m gam chất rắn thu được chứa 0,064 mol Ag và 0,008 mol Cu → m = 7,424 gam.

Đáp án C
nAg+ = 0,064 mol; nCu2+ = 0,4 mol; nNO3– = 0,864 mol.
Ta có: Al3+/Al > Fe2+/Fe > Cu2+/Cu > Fe3+/Fe2+ > Ag+/Ag.
⇒ các cation trong dung dịch xuất hiện theo thứ tự:
Al3+ → Fe2+ → Cu2+ → Fe3+ → Ag+.
► Ghép lần lượt các ion vào để thỏa bảo toàn điện tích:
Ghép 0,02 mol Al3+ và 0,01 mol Fe2+ vẫn chưa đủ.
⇒ ghép thêm (0,864 - 0,02 × 3 - 0,01 × 2) ÷ 2 = 0,392 mol Cu2+.
||⇒ Rắn gồm 0,064 mol Ag và (0,4 - 0,392 = 0,008) mol Cu
► m = 0,064 × 108 + 0,008 × 64 = 7,424(g)



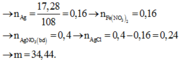

Đáp án : A
n Mg = 3,6: 24 = 0,15 mol
n Ag+ = 0,2 mol
n Cu2+ = 0,2mol
Mg + 2 Ag+ → Mg2+ + 2 Ag
0,1 0,2 0,2
Mg + Cu 2+ → Mg2+ + Cu↓
0,05 0,05 0,05
m c. rắn = 0,2 . 108 + 0,05. 64 = 24,8 gam