Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

a) $CaCO_3 + 2HCl \to CaCl_2 + CO_2 + H_2O$
Theo PTHH :
$n_{CO_2} = n_{CaCO_3} = \dfrac{10}{100} = 0,1(mol)$
$V_{CO_2} = 0,1.22,4 = 2,24(lít)$
b) $n_{HCl} = 2n_{CaCO_3} = 0,2(mol)$
$C_{M_{HCl}} = \dfrac{0,2}{0,25} = 0,8M$
c) $CO_2 + Ca(OH)_2 \to CaCO_3 + H_2O$
$n_{CaCO_3} = n_{CO_2} = 0,1(mol)$
$m_{CaCO_3} = 0,1.100 = 10(gam)$


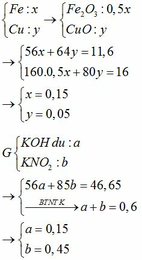
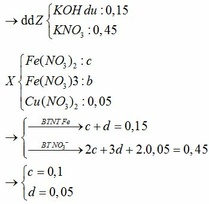

BTKL
mX + mdd HNO3 = mdd X + mH2O + m↑
=> mdd X = 11,6 + 87,5 – 30 . 0,1 – 46 . 0,15 = 89,2g
=> C%Fe(NO3)3 = 13,565%

a) nMg= 3,6/24=0,15(mol)
nHCl= (300.7,3%)/36,5= 0,6(mol)
PTHH: Mg + 2 HCl -> MgCl2 + H2
Ta có: 0,15/1 < 0,6/2
=> HCl dư, Mg hết => Tính theo nMg.
nY=nH2=nMgCl2=nMg=0,15(mol)
=>V(Y,đktc)=V(H2,đktc)=0,15.22,4=3,36(l)
b) mMgCl2=0,15.95= 14,25(g)
nHCl(dư)= 0,6- 0,15.2=0,3(mol)
=>mHCl(dư)=0,3.36,5= 10,95(g)
mddsau= mMg + mddHCl - mH2= 3,6+ 300 - 0,15.2= 303,3(g)
=>C%ddHCl(dư)= (10,95/303,3).100= 3,610%
C%ddMgCl2= (14,25/303,3).100=4,698%

– Số mol KMnO4 = 0,2 (mol); số mol KOH = 2 (mol)
– Phương trình phản ứng:
2KMnO4 + 16HCl → 2KCl + 2MnCl2 + 5Cl2 + 8H2O
0,2 0,5
* Ở điều kiện nhiệt độ thường:
Cl2 + 2KOH → KCl + KClO + H2O
0,5 1,0 0,5 0,5
– Dư 1,0 mol KOH
CM (KCl) = CM (KClO) = 0,5 (M); CM (KOH dư) = 1 (M)
* Ở điều kiện đun nóng trên 700C:
3Cl2 + 6KOH → 5KCl + KClO3 + 3H2O
0,5 1,0 5/6 1/6
– Dư 1,0 mol KOH
CM (KCl) = 5/6 (M); CM (KClO3) = 1/6 (M); CM (KOH dư) = 1 (M).

a) \(BaO+H_2O\rightarrow Ba\left(OH\right)_2\)
\(n_{Ba\left(OH\right)_2}=n_{BaO}=0,15\left(mol\right)\)
\(n_{BaCO_3}=\dfrac{23,64}{197}=0,12\left(mol\right)\)
Bảo toàn nguyên tố Ba => \(n_{Ba\left(HCO_3\right)_2}=0,15-0,12=0,03\left(mol\right)\)
Bảo toàn nguyên tố C: \(n_{CO_2}=0,12+0,03.2=0,18\left(mol\right)\)
=> \(V_{CO_2}=0,18.22,4=4,032\left(l\right)\)
b)Bảo toàn nguyên tố C : \(n_{CO_2}=n_{MgCO_3}+n_{CaCO_3}=a\left(mol\right)\)
Ta có : \(\dfrac{18,4}{100}< a< \dfrac{18,4}{84}\)
=> \(0,184< a< 0,22\)
\(n_{OH^-}=0,15.2=0,3\left(mol\right)\)
Lập T: \(\dfrac{0,3}{0,22}< T< \dfrac{0,3}{0,184}\)
=>\(1,36< T< 1,63\)
Do 1< \(1,36< T< 1,63\) <2
=> Phản ứng luôn tạo kết tủa

a, \(MnO_2+4HCl\rightarrow MnCl_2+Cl_2+2H_2O\)
Ta có: \(n_{MnO_2}=\dfrac{34,8}{87}=0,4\left(mol\right)\)
Theo PT: \(n_{Cl_2}=n_{MnO_2}=0,4\left(mol\right)\Rightarrow V_{Cl_2}=0,4.22,4=8,96\left(l\right)\)
b, \(n_{H_2}=\dfrac{11,2}{22,4}=0,5\left(mol\right)\)
PT: \(Cl_2+H_2\underrightarrow{as}2HCl\)
Xét tỉ lệ: \(\dfrac{0,4}{1}< \dfrac{0,5}{1}\), ta được H2 dư.
Theo PT: \(\left\{{}\begin{matrix}n_{H_2\left(pư\right)}=n_{Cl_2}=0,4\left(mol\right)\\n_{HCl}=2n_{Cl_2}=0,8\left(mol\right)\end{matrix}\right.\)
\(\Rightarrow n_{H_2\left(dư\right)}=0,5-0,4=0,1\left(mol\right)\)
\(\Rightarrow\left\{{}\begin{matrix}\%V_{HCl}=\dfrac{0,8.22,4}{\left(0,8+0,1\right).22,4}.100\%\approx88,89\%\\\%V_{H_2\left(dư\right)}\approx11,11\%\end{matrix}\right.\)
c, Ta có: \(m_{HCl}=0,8.36,5=29,2\left(g\right)\)
\(\Rightarrow C\%_{HCl}=\dfrac{29,2}{200}.100\%=14,6\%\)
d, \(n_{NaOH}=0,5.4=2\left(mol\right)\)
PT: \(Cl_2+2NaOH\rightarrow NaCl+NaClO+H_2O\)
Xét tỉ lệ: \(\dfrac{0,4}{1}< \dfrac{2}{2}\), ta được NaOH dư.
Theo PT: \(\left\{{}\begin{matrix}n_{NaCl}=n_{NaClO}=n_{Cl_2}=0,4\left(mol\right)\\n_{NaOH\left(pư\right)}=2n_{Cl_2}=0,8\left(mol\right)\end{matrix}\right.\)
\(\Rightarrow n_{NaOH\left(dư\right)}=2-0,8=1,2\left(mol\right)\)
\(\Rightarrow\left\{{}\begin{matrix}C_{M_{NaCl}}=C_{M_{NaClO}}=\dfrac{0,4}{0,5}=0,8\left(M\right)\\C_{M_{NaOH\left(dư\right)}}=\dfrac{1,2}{0,5}=2,4\left(M\right)\end{matrix}\right.\)