Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

D chứa 2 oxide: \(MgO,Fe_2O_3\) (oxide 2 kim loại có tính khử cao nhất)
Vậy hỗn hợp A dư, muối đồng(II) hết.
B gồm Cu, Fe
\(Mg+CuSO_4->MgSO_4+Cu\\ Fe+CuSO_4->MgSO_4+Cu\\ MgSO_4+2NaOH->Mg\left(OH\right)_2+Na_2SO_4\\FeSO_4+2NaOH->Fe\left(OH\right)_2+Na_2SO_4 \\ Mg\left(OH\right)_2-^{^{t^{^0}}}->MgO+H_2O\\2 Fe\left(OH\right)_2+\dfrac{1}{2}O_2-^{^{ }t^{^{ }0}}->Fe_2O_3+2H_2O\\ n_{Mg}=a;n_{Fe\left(pư\right)}=b\\ \Delta m\uparrow=9,2-6,8=40a+8b=2,4\left(I\right)\\ 40a+\dfrac{160b}{2}=6\left(II\right)\\ \Rightarrow a=b=0,05mol\\ m_B=9,2=64\left(a+b\right)+56n_{Fe\left(dư\right)}\\ n_{Fe\left(dư\right)}=0,05\left(mol\right)\\ \%m_{Mg}=\dfrac{24.0,05}{6,8}.100\%=17,65\%\\ \%m_{Fe}=82,35\%\)
Bước 1: Viết các phương trình phản ứng
Phản ứng 1: Mg + CuSO4 -> MgSO4 + Cu
Phản ứng 2: Fe + CuSO4 -> FeSO4 + Cu
Phản ứng 3: Cu(OH)2 -> CuO + H2O
Bước 2: Tính toán số mol của chất rắn B
Khối lượng chất rắn B = 9,2g
Khối lượng mol CuSO4 = 63.55g/mol + 32.07g/mol + (4 * 16g/mol) = 159.62g/mol
Số mol CuSO4 = 9,2g / 159.62g/mol = 0.0577 mol
Vì phản ứng 1 và phản ứng 2 xảy ra hoàn toàn, nên số mol Mg và Fe trong hỗn hợp A cần tìm là 0.0577 mol.
Bước 3: Tính toán % số mol mỗi kim loại trong A
Khối lượng mol Mg = 24.31g/mol
Khối lượng mol Fe = 55.85g/mol
% số mol Mg trong A = (0.0577 mol * 24.31g/mol) / 6.8g * 100% = 20.34%
% số mol Fe trong A = (0.0577 mol * 55.85g/mol) / 6.8g * 100% = 47.28%
Vậy, % số mol mỗi kim loại trong hỗn hợp A là: Mg: 20.34% và Fe: 47.28%.

Gọi a, b là số mol Mg, Fe phản ứng.
Mg+CuSO4→MgSO4+Cu
a_____a_______a____a
Fe+CuSO4→FeSO4+Cu
b____b_______b_____b
(Nếu giải ra b>0 thì Fe đã phản ứng. Nếu giải ra b=0 thì Fe chưa phản ứng)
MgSO4+2NaOH→Mg(OH)2+Na2SO4
a________________a
FeSO4+2NaOH→Fe(OH)2+Na2SO4
b________________b
Mg(OH)2→MgO+H2O
a_________a
4Fe(OH)2+O2→2Fe2O3+4H2O
b_____________\(\dfrac{b}{2}\)
5,1-24a-56b+64(a+b)=6,9
=> \(\left\{{}\begin{matrix}\text{5a+b=0,225
}\\40a+160\dfrac{b}{2}=4,5\end{matrix}\right.\)Giải hệ, được a=b=0,0375
%mMg=24.0,0375/5,1.100%=17,65%
%mFe=100%-17,65%=82,35%
Số mol Fe có trong A bằng\(\dfrac{\text{(5,1-24.0,0375)}}{56}\)=0,075(mol)
Fe dư và CuSO4 phản ứng hết.
nCuSO4=a+b=0,0375+0,0375=0,075(mol)
CM(CuSO4) =0,075/0,25=0,3(M)
a) Gọi \(\left\{{}\begin{matrix}n_{Mg}=a\left(mol\right)\\n_{Fe}=b\left(mol\right)\end{matrix}\right.\) => 24a + 56b = 5,1 (1)
- Nếu Fe tan hết:
Bảo toàn Mg: nMgO = a (mol)
Bảo toàn Fe: \(n_{Fe_2O_3}=0,5b\left(mol\right)\)
=> 40a + 160.0,5b = 4,5
=> 40a + 80b = 4,5 (2)
(1)(2) => Nghiệm âm (vô lí)
=> Trong X có Fe
Gọi nFe(pư) = x (mol)
PTHH: Mg + CuSO4 --> MgSO4 + Cu
a---->a------------------->a
Fe + CuSO4 --> FeSO4 + Cu
y---->y------------------->y
=> 64(a + y) + 56(b - y) = 6,9
=> 64a + 56b + 8y = 6,9 (3)
Bảo toàn Mg: nMgO = a (mol)
Bảo toàn Fe: nFe2O3 = 0,5y (mol)
=> 40a + 80y = 4,5 (4)
(1)(3)(4) => \(\left\{{}\begin{matrix}a=0,0375\left(mol\right)\\b=0,075\left(mol\right)\\y=0,0375\left(mol\right)\end{matrix}\right.\)
\(\%m_{Mg}=\dfrac{0,0375.24}{5,1}.100\%=17,647\%\)
b) \(n_{CuSO_4}=a+y=0,075\left(mol\right)\)
=> \(C_{M\left(CuSO_4\right)}=\dfrac{0,075}{0,25}=0,3M\)
c) X gồm \(\left\{{}\begin{matrix}Cu:0,075\left(mol\right)\\Fe:0,0375\left(mol\right)\end{matrix}\right.\)
PTHH: Cu + 2H2SO4 --> CuSO4 + SO2 + 2H2O
2Fe + 6H2SO4 --> Fe2(SO4)3 + 3SO2 + 6H2O
=> \(n_{SO_2}=0,13125\left(mol\right)\)
=> \(V_{SO_2}=0,13125.22,4=2,94\left(l\right)\)


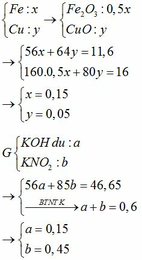
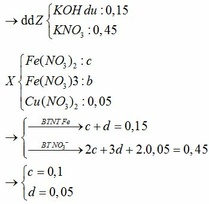

BTKL
mX + mdd HNO3 = mdd X + mH2O + m↑
=> mdd X = 11,6 + 87,5 – 30 . 0,1 – 46 . 0,15 = 89,2g
=> C%Fe(NO3)3 = 13,565%

a) PTHH: \(Mg+CuSO_4\rightarrow MgSO_4+Cu\)
a_______a________a_____a (mol)
\(Fe+CuSO_4\rightarrow FeSO_4+Cu\)
b_______b_______b_____b (mol)
\(MgSO_4+2NaOH\rightarrow Mg\left(OH\right)_2\downarrow+Na_2SO_4\)
\(FeSO_4+2NaOH\rightarrow Fe\left(OH\right)_2\downarrow+Na_2SO_4\)
\(Mg\left(OH\right)_2\xrightarrow[]{t^o}MgO+H_2O\)
\(4Fe\left(OH\right)_2+O_2\xrightarrow[]{t^o}2Fe_2O_3+4H_2O\)
b) Ta có: \(n_{CuSO_4}=0,3\cdot1=0,3\left(mol\right)=n_{Cu}\)
\(\Rightarrow m_{Fe\left(dư\right)}=24,8-0,3\cdot64=5,6\left(g\right)\) \(\Rightarrow m_{Fe\left(p/ứ\right)}+m_{Mg}=16-5,6=10,4\left(g\right)\)
Ta lập hệ phương trình: \(\left\{{}\begin{matrix}24a+56b=10,4\\a+b=0,3\end{matrix}\right.\) \(\Leftrightarrow\left\{{}\begin{matrix}a=0,2\\b=0,1\end{matrix}\right.\)
\(\Rightarrow\left\{{}\begin{matrix}\%m_{Mg}=\dfrac{0,2\cdot24}{16}\cdot100\%=30\%\\\%m_{Fe}=70\%\end{matrix}\right.\)
c) Theo các PTHH: \(\left\{{}\begin{matrix}n_{MgO}=n_{Mg}=0,2\left(mol\right)\\n_{Fe_2O_3}=\dfrac{1}{2}n_{Fe\left(p/ứ\right)}=0,05\left(mol\right)\end{matrix}\right.\)
\(\Rightarrow m_{rắn}=m_{MgO}+m_{Fe_2O_3}=0,2\cdot40+0,05\cdot160=11\left(g\right)\)
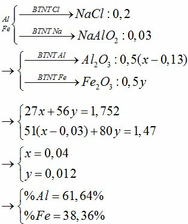






Mg +CuSO4\(\rightarrow\) MgSO4+Cu(1)
Fe+CuSo4\(\rightarrow\) FeSO4+Cu(2)
MgSO4+2NaOH\(\rightarrow\) Mg(OH)2+ Na2SO4(3)
FeSo4+2NaOH\(\rightarrow\) Fe(OH)2+ Na2SO4(4)
Mg(OH)2\(\underrightarrow{^{to}}\) MgO+H2O(5)
4Fe(OH)2+O2\(\rightarrow\) 2Fe2O3 +4H2O( t độ)(6)
mFe+mMg=3,28g
Theo pt 1,2,3,4,5,6 mà mFe2O3 + mMgO=2,4g\(\rightarrow\) Vô lí(2,4<3,28)
Vậy CuSO4 thiếu , kim loại dư
*Giả sử chỉ có Mg phản ứng
Mg+CuSO4\(\rightarrow\) MgSO4+Cu(1)
a(mol)
a=\(\frac{\text{4,24-3,28}}{64-56}\)=0,024 mol
2NaOH+ MgSo4\(\rightarrow\) Mg(OH)2 +Na2SO4(2)
Mg(OH)2\(\rightarrow\) MgO+H2O( t độ)(3)
Theo 1,2,3: nMgO=0,024 mol
\(\rightarrow\)mMgO=0,024.40=0,96g<2,4g\(\rightarrow\)Vô lí
Vậy Fe tham gia phản ứng và Mg phản ứng hết
* Gọi x là số mol Mg, y là số mol của Fe phản ứng hết
Theo 2,4,6, ta có hpt:
40x+8y=4,24-3,28
40x+80y=2,4
\(\rightarrow\) x=y=0,02
CM CuSO4=0,04:0,4=0,1M
b) Ta có mMg=0,02.24=0,48g
%mMg=14,63%
%mMgO=100%-14,63%=85,37%