Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

MgCO3 + 2HCl → MgCl2 + CO2 + H2O (1)
BaCO3 + 2HCl → BaCl2 + CO2 + H2O (2)
CO2 + Ca(OH)2 → CaCO3↓ + H2O. (3)
Theo (1), (2) và (3), để lượng kết tủa B thu được là lớn nhất thì:
nCO2 = nMgCO3 + nBaCO3 = 0,2 mol
Ta có: 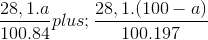 = 0,2
= 0,2
=> a = 29,89.

bạn có ghi bài trên lớp phần cấu tạo chất đủ không. co mình mượn chép lại mấy bài phần đó với

Các cặp chất là đổng đẳng của nhau : C3H7OH và C4H9OH;
CH3 - О - C2H5 và C2H3 - О - C2H5
Các cặp chất là đồng phân của nhau : CH3-O-C2H5 và C3H7OH;
C2H5-O-C2H5 và C4H9OH.

C2H2 + 2AgNO3 + 2NH3 → C2Ag2 ↓ + 2NH4NO3
CH3CHO + 2AgNO3 + 3NH3 + H2O → CH3COONH4 + 2Ag ↓ + 2NH4NO3
C2Ag2 + 2HCl → 2AgCl ↓ + C2H2 ↑
Y(AgCl, Ag) + HNO3 --> ...
Ag + 2HNO3 → AgNO3 + NO2 ↑ + H2O

a) Ta có: Mật độ xác suất tìm thấy electron trong vùng không gian xung quanh hạt nhân nguyên tử:
D(r) = R2(r) . r2
= 416/729 . a0-5 . r2 . (2 - r/3a0)2 . e-2r/3a0 . r2
= 416/729 . a0-5 . (4r4 - 4r5/3a0 + r6/9a02) . e-2r/3a0
Khảo sát hàm số D(r) thuộc r
Xét: d D(r)/ dr = 416/729 . a0-5 . [(16r3 - 20r4/3a0 + 2r5/3a02) . e-2r/3a0 - (4r4 - 4r5/3a0 + r6/9a02) . 2/3a0 . e-2r/3a0 ]
= 416/729 . a0-5 . e-2r/3a0 . r3 . (16a03 - 28r/3a0 + 14r2/9a02 - 2r3/27a03)
= 832/19683 . a0-8 . e-2r/3a0 . r3 . (-r3 +21r2.a0 - 126r.a02 +216a03)
= - 832/19683 . a0-8 . e-2r/3a0 . r3 . (r - 6a0).(r - 3a0).(r - 12a0)
d D(r)/ dr = 0. Suy ra r =0; r =3a0 ; r = 6a0; r = 12a0
Với r = 0 : D(r) =0
r =3a0 : D(r) = 416/9 .a-1 . e-2
r =6a0 : D(r) = 0
r =12a0 : D(r) = 425984/9.a-1 . e-8
b) Ai vẽ câu này rồi cho up lên với, cám ơn mọi người trước nhé!
a)Mật độ xác suất có mặt electron tỷ lệ với |R3P|2.r2
D(r)=|R3P|2.r2 =D (r)=\(\frac{416}{729}\) .a0-5.(2r2- \(\frac{r^3}{3a_0}\)).\(^{e^{-\frac{2r}{3a_0}}}\)
Lấy đạo hàm của D theo r để khảo sát mật độ xác suất :
D' (r)= \(\frac{416}{729}\) .a0-5.2.(2r2-\(\frac{r^3}{3a_0}\)).(4r-\(\frac{r^2}{a_0}\)).\(^{e^{-\frac{2r}{3a_0}}}\)+\(\frac{416}{729}\) .a0-5.(2r2-\(\frac{r^3}{3a_0}\))2.(-\(\frac{2}{3a_0}\)).\(^{e^{-\frac{2r}{3a_0}}}\)
=\(\frac{832}{729}\). a0-6.\(^{e^{-\frac{2r}{3a_0}}}\). (2r2-\(\frac{r^3}{3a_0}\)) .[(4r-\(\frac{r^2}{a_0}\)).a0 -\(\frac{1}{3}\). (2r2-\(\frac{r^3}{3a_0}\))]
=\(\frac{832}{729}\). a0-6.\(^{e^{-\frac{2r}{3a_0}}}\).r3.(2- \(\frac{r}{3a_0}\)).(\(\frac{r^2}{9a_0}-\frac{5r}{3}+4a_0\))
=>D’(r)=0 => r=0 ,r=3a0 ,r=6a0 ,r=12a0.
Với:r=0 =>D(r)=0
r=3a0 =>D(r)=0
r=6a0 =>D(r)=\(\frac{416}{9a_0.e^2}\)
r=12a0=>D(r)=\(\frac{425984}{a_0.e^8}\)
b)

Số mol H3PO4: 0,050 x 0,50 = 0,025 (mol).
H3PO4 + 3NaOH → Na3PO4 + 3H2O
1 mol 3 mol
0,025 mol 3 x 0,025 mol
Thể tích dung dịch NaOH: 0,075 lít hay 75 ml

m chất rắn giảm =m oxi mất đi => n [O]=0,32/16=0,02 (mol)
n CO,H2= n [O]=0,02 (mol)
=> V =0,02.22,4=0,448 lít
Định hướng tư duy giải
Nhận thấy
82 , 38 855 = 1373 14250
=> rất lẻ