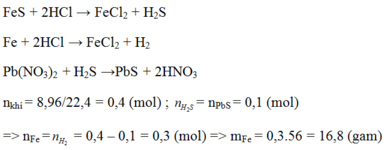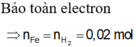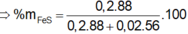Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

\(n_{Na_2S}=\dfrac{7,8}{78}=0,1mol\)
\(Na_2S+Pb\left(NO_3\right)_2\rightarrow2NaNO_3+PbS\downarrow\)
0,1 0,1
\(m_{PbS}=0,1\cdot\left(207+32\right)=23,9g\)
Chọn A.

Đáp án A
Khi cho kẽm vào dung dịch Y, sau khi phản ứng xong thì thấy khối lượng thanh kẽm tăng nên trong Y phải có ion Ag+. Do AgNO3 dư nên đặt


- Chất rắn không tan trong HCL dư là S => m S dư = 3,8g
Kết tủa đen là CuS => n CuS = 0,1 = n H 2 S = nS phản ứng
m S phản ứng = 3,2g
0,2 mol Z gồm 0,1 mol H 2 S và 0,1 mol H 2
m ban đầu = 3,8 + 3,2 = 7g
Ta lại có
n Fe p / u = n S p / u = 0,1 mol
n Fe dư = n H 2 = 0,1 mol
n Fe ban đầu → m Fe ban đầu = 0,2 .56 = 1,12 g
Vậy m = 11,2 + 0,7 = 18,2 (gam)

Đáp án A
nX = 0,4 (mol)
n↓ = nPbS = 0,1 (mol)
Pb(NO3)2 + H2S →PbS + 2HNO3
![]()

\(n_B=\frac{4,928}{22,4}=0,22\left(mol\right)\)
Hỗn hợp khí B gồm H2 và H2S
\(Pb\left(NO_3\right)_2+H_2S\rightarrow PbS+2HNO_3\)
\(n_{PbS}=\frac{47,8}{239}=0,2\left(mol\right)\)
Theo PT :
\(n_{H2S}=n_{PbS}=0,2\left(mol\right)\Rightarrow V_{H2S}=0,2.22,4=4,48\left(l\right)\)
\(n_{H2}=n_B-n_{H2S}=0,22-0,2=0,02\left(mol\right)\)
\(\Rightarrow V_{H2}=0,02.22,4=4,48\left(l\right)\)
\(Fe+2HCl\rightarrow FeCl_2+H_2\)
0,02________________0,02
\(FeS+2HCl\rightarrow FeCl_2+H_2S\)
0,2 _____________________0,2
\(n_{Fe}=n_{H2}=0,02\left(mol\right);n_{FeS}=n_{H2S}=0,2\left(mol\right)\)
\(\Rightarrow m=m_{Fe}+m_{FeS}=0,02.56+0,2.88=18,72\left(g\right)\)