Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Chọn B.
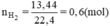
2Al + 2NaOH + 2H2O → 2NaAlO2 + 3H2 ↓
Al2O3 + 2NaOH → 2NaAlO2 + H2O
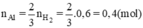
⇒ mAl = 27.0,4 = 10,8 (gam); mAl2O3 = 31,2 - 10,8 = 20,4 (gam).

Đáp án D
Khi hòa tan hỗn hợp vào dung dịch NaOH dư thì chỉ có Al và A12O3 bị hòa tan.
Khi đó 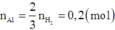
Khi hòa tan hỗn hợp vào dung dịch HCl (dư) thì cả ba chất trong hỗn hợp đều tan.
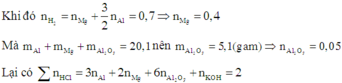
=> V = 2 (lít)

PTHH: 2Al + 2NaOH + 2H2O ===> 2NaAlO2 + 3H2 (1)
Al2O3 + 2NaOH ===> 2NaAlO2 + H2O (2)
Ta có: nH2 = \(\dfrac{13,44}{22,4}=0,6\left(mol\right)\)
Theo (1), nAl = \(\dfrac{0,6\cdot2}{3}=0,4\left(mol\right)\)
=> \(\left\{{}\begin{matrix}m_{Al}=0,4\cdot27=10,8\left(gam\right)\\m_{Al2O3}=31,2-10,8=20,4\left(gam\right)\end{matrix}\right.\)
=> Chọn đáp án B là đúng
Chọn B.
nH2 = 0,6 (mol).
2Al + 2NaOH + 2H2O → 2NaAlO2 + 3H2↑
0,4 0,6 (mol)
Al2O3 + 2NaOH → 2NaAlO2 + H2O
=> mAl = 27.0,4 = 10,8 (gam)
mAl2O3 = 31,2 -10,8 = 20,4 (gam).

Giải thích:
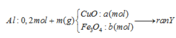
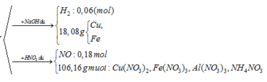
Coi trong mỗi phần có 0,2 mol Al
- Rắn Y + NaOH → 0,06 nH2
BT: e => nAl DƯ = 2/3 nH2 = 2/3. 0,06 = 0,04 ( mol)
BTNT: Al => nAl2O3 = ½ ( nAlbđ – nAl dư) = ½ ( 0,2 – 0,04) = 0,08 (mol)
BTKL: m = mFe, Cu + mO = 18,08 + 0,08.3.16 = 21,92 (g)
=> 80a + 232b = 21,92 (1)
- Rắn Y + HNO3
Sau tất cả quá trình ta có: Al → Al+3 ; Fe+8/3 → Fe+3, N+5 → N+2; N+5→ N-3
BT e ta có: 3nAl + nFe3O4 = 3nNO + 8nNH4NO3
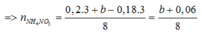
mmuối = mAl(NO3)3 + mCu(NO3)3 + mFe(NO3)3 + mNH4NO3
=>213.0,2 +188a + 242.3b + 80 ( b+0,06)/8 = 106,12 (2)
Từ (1) và (2) => a = 0,1 và b = 0,06
=> mFe3O4 = 232.2b = 232.2.0,1= 27,84 (g) ( Vì hỗn hợp ban đầu nên phải nhân đôi số liệu)
Đáp án A
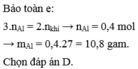
2Al + 2NaOH + 2H2O → 2NaAlO2 + 3H2 ↓
Al2O3 + 2NaOH → 2NaAlO2 + H2O
⇒ mAl = 27.0,4 = 10,8 (gam); mAl2O3 = 31,2 - 10,8 = 20,4 (gam).
Chọn B