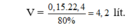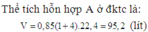Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

$n_{N_2} = 0,4(mol) ; n_{H_2} = 0,9(mol) ; n_{NH_3} = 0,2(mol)$
$N_2 + 3H_2 \buildrel{xt,t^,p}\over\rightleftharpoons 2NH_3$
Ta thấy :
$n_{N_2} : 1 > n_{H_2} : 3$ do đó hiệu suất tính theo số mol Hidro
$n_{H_2\ pư} = \dfrac{3}{2}n_{NH_3} = 0,3(mol)$
$H = \dfrac{0,3}{0,9}.100\% = 33,33\%$

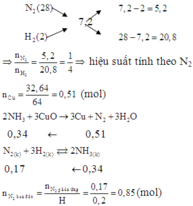
\(n_{N_2}=a,n_{H_2}=b\\ M_A=\dfrac{28a+2b}{a+b}=7,2\\ a=4b\\ PT:\dfrac{1}{2}N_2+\dfrac{3}{2}H_2-Fe,t^{^0}->NH_3\\ CuO+H_2-t^{^0}->Cu+H_2O\\ n_{Cu}=n_{H_2dư}=\dfrac{32,64}{64}=0,51mol\\ n_{H_2pư}=b-0,51\left(mol\right)\\ H=\dfrac{b-0,51}{b}=0,2\\ b=0,6375\\ a=2,55\\ V_A=22,4\left(0,6375+2,55\right)=71,4L\)

Chọn A
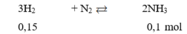
Do hiệu suất phản ứng là 80% nên thể tích H 2 cần dùng là: