Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.
Cho 2,24lit halogen X2 ở đktc tác dụng vừa đủ với magie thu được 9,5 g mgX2 .tìm nguyên tố halogen X

Mg + X2 -> MgX2
nX2 = 2,24/22,4 = 0,1 ( mol )
=> nMgX2 = 0,1 ( mol )
=> M = 9,5 / 0,1 = 95 ( đvC )
mà : MgX2 = 24 + X.2 = 95
=> X = 35,5 ( Cl )
Đó là Clo
nX2 = 2,24/22,4 = 0,1 (mol)
PTHH: Mg + X2 -> (t°) MgX2
nMgX2 = nX2 = 0,1 (mol)
M(MgX2) = 9,5/0,1 = 95 (g/mol)
<=> 24 + X . 2 = 95
<=> X = 35,5
<=> X là Cl

\(n_{X_2}=\dfrac{1,12}{22,4}=0,05\left(mol\right)\)
PTHH: \(Cu+X_2->CuX_2\)
Theo PT ta có: \(n_{CuX_2}=n_{X_2}=0,05\left(mol\right)\)
=> \(M_{CuX_2}=\dfrac{11,2}{0,05}=224\left(g/mol\right)\)
=> Ta có: \(64+2.X=224\)
\(\Leftrightarrow2X=160\Leftrightarrow X=80\left(Br\right)\)
Vậy nguyên tố halogen đó là Brom (Br)
X2 + Cu → CuX2
\(n_{X_2}=\dfrac{1,12}{22,4}=0,05\left(mol\right)\)
Theo PT: \(n_{CuX_2}=n_{X_2}=0,05\left(mol\right)\)
\(\Rightarrow M_{CuX_2}=\dfrac{11,2}{0,05}=224\left(g\right)\)
\(\Leftrightarrow64+2M_X=224\)
\(\Leftrightarrow2M_X=160\)
\(\Leftrightarrow M_X=80\left(g\right)\)
Vậy X là nguyên tố Brom

Theo đề, ta có: \(n_{X_2}=\dfrac{1,12}{22,4}=0,05\left(mol\right)\)
PTTH: \(X_2+Cu\rightarrow CuX_2\)
Số mol: 0,05 ----------> 0,05
Theo phương trình, có: \(n_{CuX_2}=n_{Cu}=0,05\left(mol\right)\)
Hay: \(\dfrac{11,2}{64+X.2}=0,05\Leftrightarrow X=80\)
Vậy X là Brom.
Chon (B)

- Gọi công thức của muối barihalogennua là BaR2 .
PTHH : \(BaR_2+H_2SO_4\rightarrow BaSO_4+2HR\)
- Gỉa sử số mol vừa đủ H2SO4 là 1 mol .
- Theo PTHH : \(n_{BaR_2}=n_{H_2SO_4}=n_{BaSO_4}=1\left(mol\right)\)
- Theo PTHH : \(n_{HR}=2n_{H_2SO_4}=2\left(mol\right)\)
\(m_{H_2SO_4}=n.M=1.98=98\left(g\right)\)
\(m_{ddH_2SO_4}=\frac{m_{H_2SO_4}.100\%}{C\%_{H_2SO_4}}=\frac{98.100\%}{5\%}=1960\left(g\right)\)
\(m_{BaR_2}=n.M=1.\left(137+2M_R\right)=137+2M_R\left(g\right)\)
\(m_{BaSO_4}=n.M=1.\left(137+32+16.4\right)=233\left(g\right)\)
- Ta có : \(m_{dd}=m_{H_2SO_4}+m_{BaR_2}-m_{BaSO_4}\)
=> \(m_{dd}=137+2M_R-233+1960=1864+2M_R\)
\(m_{HR}=n.M=2.M_{HR}=2.\left(M_R+1\right)\left(g\right)\)
Mà \(C\%_{HR}=\frac{m_{HR}}{m_{dd}}.100\%=3,77\%\)
=> \(\frac{2M_R+2}{1864-2M_R}=\frac{3,77}{100}\)
=> \(M_R\approx35,5\) ( đvc )
Vậy tên của halogen là clo .

1/
gọi kim loại cần tìm là A
ta có: nH2= \(\dfrac{2,24}{22,4}\)= 0,1( mol)
PTPU
2A+ 2HCl\(\rightarrow\) 2ACl+ H2\(\uparrow\)
0,2.............................0,1... mol
\(\Rightarrow\) MA. 0,2= 7,8
\(\Rightarrow\) MA= \(\dfrac{7,8}{0,2}\)= 39( g/mol)
vậy kim loại cần tìm là kali( K)
mk chắc v
2/
gọi kim loại cần tìm là R
ta có: nH2= \(\dfrac{3,36}{22,4}\)= 0,15( mol)
PTPU
2R+ 2H2O\(\rightarrow\) 2ROH+ H2\(\uparrow\)
0,3...............................0,15.. mol
\(\Rightarrow\) 0,3.MR= 6,9
\(\Rightarrow\) MR= \(\dfrac{6,9}{0,3}\)= 23( g/mol)
vậy kim loại cần tìm là natri( Na)

BTKL: mNa + mX2 = m muối \(\rightarrow\) mNa = 17,04 - 12,44 = 4,6 gam \(\rightarrow\) nNa = 0,2 mol
2Na + X2 \(\rightarrow\)2NaX
0,2_________0,2
Ta có: 0,2. (23+X) = 17,04 \(\rightarrow\) X = 62,2 \(\rightarrow\)2 halogen là clo và brom
Gọi số mol của NaCl và NaBr lần lượt là a, b mol
BTNT \(\rightarrow\) nNaCl = 2a; nNaBr = 2b
Ta có hệ phương trình: 71a +160b = 12,44 (1); 58,5. 2a + 103. 2b = 17,04 (2)
\(\rightarrow\) a = 0,04; b = 0,06
%m NaCl = 18,8%
BTKL: mNa + mX2 = m muối => mNa = 17,04 - 12,44 = 4,6 gam => nNa = 0,2 mol
2Na + X2 -> 2NaX
mol 0,2 ->0,2
Ta có: 0,2. (23+X) = 17,04 => X = 62,2 => 2 halogen là clo và brom
Gọi số mol của NaCl và NaBr lần lượt là a, b mol
BTNT => nNaCl = 2a; nNaBr = 2b
Ta có hệ phương trình: 71a +160b = 12,44 (1); 58,5. 2a + 103. 2b = 17,04 (2)
=> a = 0,04; b = 0,06
%m Cl2 = (0,04. 71. 100): 12,44 =22,82%
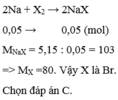
\(X_2+Mg\rightarrow MgX_2\)
0,1__________0,1
\(n_{X2}=\frac{2,24}{22,4}=0,1\left(mol\right)\)
\(M_{MgX2}=\frac{9,5}{0,1}=95\)
\(\Rightarrow X=35,5\left(Cl\right)\)