Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Thể tích khí đã tác dụng với dung dịch brom là : 6,72 - 2,24 = 4,48 (lít).
=> Số mol khí phản ứng với dung dịch brom là : 4,48/22,4 = 0,2 mol
Khối lượng bình brom tăng lên là do khối lượng hiđrocacbon bị hấp thụ. Vậy khối lượng mol phân tử của hiđrocacbon là :
5,6/0,2 = 28 (gam/mol)
=> Công thức phân tử của một hiđrocacbon là C 2 H 4
Dựa vào phản ứng đốt cháy tìm được hiđrocacbon còn lại là CH 4
% V C 2 H 4 = 4,48/6,72 x 100% = 66,67%; V CH 4 = 33,33%

\(C_2H_2+2Br_2->C_2H_2Br_4\\ n_{hh}=\dfrac{3,36}{22,4}=0,15mol\\ n_{CH_4}=\dfrac{2,24}{22,4}=0,1mol\\ n_{C_2H_2}=0,05mol\\ n_{Br_2}=2.0,05=0,1mol\\ m_{Br_2}=0,1.160=16g\\ \%V_{CH_4}=\dfrac{0,1}{0,15}.100\%=66,67\%\\ \%V_{C_2H_2}=33,33\%\)

a. Phương trình phản ứng giữa axetilen và dung dịch Br2:
C2H2 + Br2 → C2H2Br2
b. Theo định luật Avogadro, số mol khí thể tích bằng nhau ở cùng điều kiện nhiệt độ và áp suất. Vì vậy, số mol của hỗn hợp Y bằng số mol của khí thoát ra sau phản ứng.
Theo đó, ta có thể tính số mol mỗi khí trong hỗn hợp:
Số mol khí thoát ra: n = V/ Vm = 2,24/ 22,4 = 0,1 molSố mol axetilen ban đầu: n(C2H2) = n = 0,1 molSố mol metan ban đầu: n(CH4) = (V(Y) - V(C2H2)) / Vm = (3,36 - 2,24) / 22,4 = 0,05 molc. Để tính % về khối lượng từng khí trong hỗn hợp, ta cần biết khối lượng riêng của từng khí. Ở đktc, khối lượng riêng của axetilen là 1,096 g/L và khối lượng riêng của metan là 0,717 g/L.
Khối lượng axetilen trong hỗn hợp: m(C2H2) = n(C2H2) x M(C2H2) = 0,1 x 26 = 2,6 gKhối lượng metan trong hỗn hợp: m(CH4) = n(CH4) x M(CH4) = 0,05 x 16 = 0,8 gTổng khối lượng của hỗn hợp Y: m(Y) = V(Y) x ρ(Y) = 3,36 x 1,25 = 4,2 gVậy, % về khối lượng của axetilen trong hỗn hợp là:
% m(C2H2) = (m(C2H2) / m(Y)) x 100% = (2,6 / 4,2) x 100% = 61,9%
% về khối lượng của metan trong hỗn hợp là:
% m(CH4) = (m(CH4) / m(Y)) x 100% = (0,8 / 4,2) x 100% = 19,0%

Tham khảo:
a. PTHH: C2H2 + 2Br2 ---> C2H4Br2
Khí thoát ra là CH4 => nCH4 = 0,1 (mol) . Mà tổng n khí = 0,15 (mol)
=> nC2H2 = 0,05 (mol)
b. %V CH4 = 0,1/0,15 . 100% = 66,67%
%V C2H2 = 33,33%
c. CH4 + 2O2 ==> CO2 + 2H2O
C2H2 + 5/2O2 ==> 2CO2 + H2O
Tổng số mol của O2: 0,1.2 + 0,05. 2,5 = 0,325 (mol)
=> V O2 = 0,325. 22,4 = 7,28 (l)
=> V kk = 7,28 / 20% = 36,4 (l)

\(n_{H_2O}=\dfrac{1,8}{18}=0,1mol\Rightarrow m_H=0,2g\)
\(n_{CO_2}=\dfrac{2,24}{22,4}=0,1mol\Rightarrow m_C=1,2g\)
Có \(m_C+m_H=m_A\Rightarrow A\) chỉ chứa C,H.
Gọi CTHH là \(C_xH_y\)
\(x:y=n_C:n_H=0,1:0,2=1:2\)
\(\Rightarrow CH_2\)

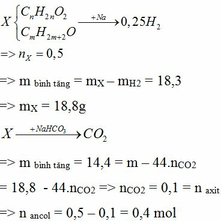

Gọi công thức chung của A, B là \(C_{\overline{n}}H_{2\overline{n}+2-2k}\) (\(\overline{n}\ge2\))
=> \(M_{C_{\overline{n}}H_{2\overline{n}+2-2k}}=\dfrac{3,28}{\dfrac{2,24}{22,4}}=32,8\left(g/mol\right)\)
=> \(14\overline{n}+2-2k=32,8\)
Mà \(2\overline{n}+2-2k>0=>k< \overline{n}+1\)
=> \(2\le\overline{n}< 2,7333\)
=> Có 1 hidrocacbon có 2 C, 1 hidrocacbon có nhiều hơn 2 C trong phân tử
Do \(\dfrac{M_A}{M_B}=\dfrac{10}{7}>1=>M_A>M_B\)
TH1: Giả sử hidrocacbon có 2 C là C2H2
=> \(M_B=M_{C_2H_2}=26\left(g/mol\right)\)
=> \(M_A=\dfrac{260}{7}\left(L\right)\)
TH2: Giả sử hidrocacbon có 2 C là C2H4
=> \(M_B=M_{C_2H_4}=28\left(g/mol\right)\)
=> \(M_A=40\left(g/mol\right)\)
=> A là C3H4