Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Xét thí nghiệm 2: chú ý tính thụ động hóa của kim loại:
H2SO4 đặc, nguội không phản ứng với Al, Cr, Fe!
⇒ trong X chỉ có Cu phran ứng. Bảo toàn electron: n Cu = n SO 2 = 0 , 075 mol.
Đặt n Cr = x mol; n Fe = y mol → m X 52x + 56y + 0,075 × 64 = 18,2 gam.
x + y = 0,25 mol. Giải hệ có: x = 0,15 mol; y = 0,1 mol.
mCr trong X = 42,86% và %mCu trong X = 26,37%
Đáp án A

Đáp án C
Đặt số mol của M2CO3, MHCO3, MCl là x,y,z mol
Đun nóng X :
2MHCO3 → M2CO3 + H2O + CO2
mrắn giảm = 18. y/ 2 + 44.y/2 =20,29 -18,74 → y = 0,05 mol
X tác dụng với 0,5 mol HCl :
M2CO3 + 2HCl → 2MCl + H2O + CO2
MHCO3 + HCl → MCl + H2O + CO2
nCO2 = x + y = 0,15 → x =0,1mol → nHCl phản ứng = 2.0,1 + 0,05 =0,25 mol < nHCl ban đầu
→ HCl dư
Dd Y có MCl và có thể có HCl dư
Ag+ + Cl- → AgCl
0,52 mol
→ nCl- = 0,52 = nHCl + nMCl (ban đầu) = 0,5 + z → z = 0,02 mol
Ta có mX = 0,1 (2M + 60) + 0,05 ( M + 61) + 0,02 (M + 35,5) → M = 39 (K)
Trong KCl thì %K = 39/74,5 .100% =52,35 %

Đáp án A
Các phản ứng có thể xảy ra:
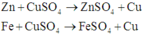
Trong 3 kim loại Zn, Fe và Cu thì Fe có khối lượng mol nhỏ nhất
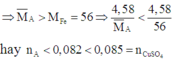
Do đó B chứa Cu2+ dư
Khi đó C chứa Cu trong A và Cu sinh ra sau phản ứng. Nên D chứa CuO.
B chứa Zn2+, Fe2+ và Cu2+ dư. Khi cho B tác dụng với dung dịch NaOH dư thì kết tủa thu được chứa Fe(OH)2 và Cu(OH)2 .
Do đó E chứa Fe2O3 và CuO.
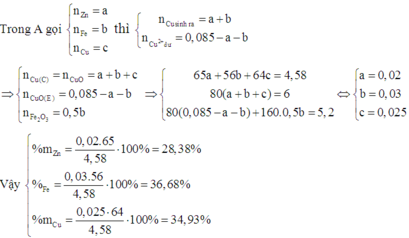

- Xét TN2:
\(n_{H_2}=\dfrac{6,72}{22,4}=0,3\left(mol\right)\)
PTHH: 2Al + 2NaOH + 2H2O --> 2NaAlO2 + 3H2
0,2<--------------------------------0,3
=> mAl = 0,2.27 = 5,4 (g)
- Xét TN1:
\(n_{H_2}=\dfrac{10,08}{22,4}=0,45\left(mol\right)\)
PTHH: 2Al + 6HCl --> 2AlCl3 + 3H2
0,2------------------->0,3
Mg + 2HCl --> MgCl2 + H2
0,15<------------------0,15
=> mMg = 0,15.24 = 3,6 (g)

Gọi x, y (mol) lần lượt là số mol Mg, Al trong hỗn hợp.
Phương trình phản ứng:
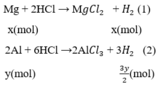
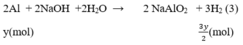
Số mol H2
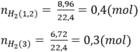
Theo bài ra ta có hệ phương trình:
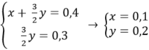
mMg = 24.0,1 = 2,4(g)
mAl = 27.0,2 = 5,4(g)

\(Fe+2HCl\rightarrow FeCl_2+H_2\)
Chất rắn không tan : Cu
\(m_{Cu}=3.2\left(g\right)\Rightarrow m_{Fe}=8-3.2=4.8\left(g\right)\)
\(\%Fe=\dfrac{4.8}{8}\cdot100\%=60\%\)
\(\%Cu=100\%-60\%=40\%\)


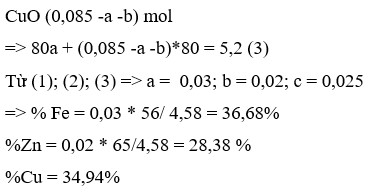
Ta có nH2 = \(\dfrac{2,24}{22,4}\) = 0,1 ( mol )
Vì Cu và Ag không tác dụng được với HCl
Zn + 2HCl \(\rightarrow\) ZnCl2 + H2
0,1.......0,2.........0,1......0,1
=> mZn = 65 . 0,1 = 6,5 ( gam )
2Zn + O2 \(\rightarrow\) 2ZnO
0,1................0,1
2Cu + O2 \(\rightarrow\) 2CuO
x......................x
4Ag + O2 \(\rightarrow\) 2Ag2O
y......................y/2
=> mZnO = 81 . 0,1 = 8,1 ( gam )
Ta có mZnO + mCuO + mAg2O = 20 + 3,2 = 23,2 ( gam )
=> mCuO + mAg2O = 23,2 - 8,1 =15,1 ( gam )
mà ta có mCu + mAg = 20 - 6,5 = 13,5 ( gam )
=> \(\left\{{}\begin{matrix}64x+108y=13,5\\80x+232\dfrac{y}{2}=15,1\end{matrix}\right.\)
=> \(\left\{{}\begin{matrix}x=\dfrac{81}{1520}\\y=\dfrac{71}{760}\end{matrix}\right.\)
=> %mZn = \(\dfrac{6,5}{20}\times100\) = 32,5 %
=> mCu = 64 . \(\dfrac{81}{1520}\) = 3,4 ( gam )
=> %mCu = \(\dfrac{3,4}{20}\) . 100 = 17 %
=> %mAg = 100 - 32,5 - 17 = 50,5 %