Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

\(m_{H_2SO_4}=19,6\left(g\right)\Rightarrow n_{H_2SO_4}=0,2\left(mol\right)\)
\(m_{KOH}=11,2\left(g\right)\Rightarrow n_{KOH}=0,2\left(mol\right)\)
PTHH: \(H_2SO_4+2KOH\rightarrow K_2SO_4+2H_2O\)
\(\Rightarrow H_2SO_4\) dư.
\(\Rightarrow n_{H_2SO_4dư}=0,3\left(mol\right);n_{K_2SO_4}=0,1\left(mol\right)\)
\(\Rightarrow C\%_{H_2SO_4dư}=\dfrac{0,3.98}{400}.100\%=7,35\%\)
\(C\%_{K_2SO_4}=\dfrac{0,1.174}{400}.100\%=4,35\%\)

Bài 1:
PTHH: \(Mg+2HCl\rightarrow MgCl_2+H_2\uparrow\)
Ta có: \(n_{Mg}=\dfrac{4,8}{24}=0,2\left(mol\right)\)
\(\Rightarrow\left\{{}\begin{matrix}n_{HCl}=0,4\left(mol\right)\\n_{H_2}=0,2\left(mol\right)\end{matrix}\right.\) \(\Rightarrow\left\{{}\begin{matrix}m_{ddHCl}=\dfrac{0,4\cdot36,5}{14,6\%}=100\left(g\right)\\V_{H_2}=0,2\cdot22,4=4,48\left(l\right)\end{matrix}\right.\)
Bài 2:
PTHH: \(2KOH+H_2SO_4\rightarrow K_2SO_4+2H_2O\)
Ta có: \(\left\{{}\begin{matrix}n_{KOH}=\dfrac{100\cdot11,2\%}{56}=0,2\left(mol\right)\\n_{H_2SO_4}=\dfrac{150\cdot9,8\%}{98}=0,15\left(mol\right)\end{matrix}\right.\)
Xét tỉ lệ: \(\dfrac{0,2}{2}< \dfrac{0,15}{1}\) \(\Rightarrow\) H2SO4 còn dư, KOH p/ứ hết
\(\Rightarrow\left\{{}\begin{matrix}n_{K_2SO_4}=0,1\left(mol\right)\\n_{H_2SO_4\left(dư\right)}=0,05\left(mol\right)\end{matrix}\right.\) \(\Rightarrow\left\{{}\begin{matrix}m_{K_2SO_4}=0,1\cdot174=17,4\left(g\right)\\m_{H_2SO_4\left(dư\right)}=0,05\cdot98=4,9\left(g\right)\end{matrix}\right.\)
Mặt khác: \(m_{dd}=m_{ddKOH}+m_{ddH_2SO_4}=250\left(g\right)\)
\(\Rightarrow\left\{{}\begin{matrix}C\%_{K_2SO_4}=\dfrac{17,4}{250}\cdot100\%=6,96\%\\C\%_{H_2SO_4\left(dư\right)}=\dfrac{4,9}{250}\cdot100\%=1,96\%\end{matrix}\right.\)

\(m_{H_2SO_4}=\dfrac{19,6.100}{100}=19,6\left(g\right)\\ \rightarrow n_{H_2SO_4}=\dfrac{19,6}{98}=0,2\left(mol\right)\)
PTHH: 2KOH + H2SO4 ---> K2SO4 + 2H2O
0,4<-----0,2--------->0,2
\(\rightarrow m_{ddKOH}=\dfrac{0,4.56}{5,6\%}=400\left(g\right)\\ m_{dd\left(sau.pư\right)}=400+100=500\left(g\right)\\ m_{K_2SO_4}=174.0,2=34,8\left(g\right)\\ \rightarrow C\%_{K_2SO_4}=\dfrac{34,8}{500}.100\%=6,96\%\)
\(n_{H_2SO_4}=\dfrac{100.19,6\%}{98}=0,2mol\)
\(2KOH+H_2SO_4\rightarrow K_2SO_4+2H_2O\)
0,4 0,2 0,2 ( mol )
\(m_{ddKOH}=\dfrac{0,4.56}{5,6\%}=400g\)
\(C\%_{K_2SO_4}=\dfrac{0,2.174}{100+400}.100=6,96\%\)

a, \(Fe+H_2SO_4\rightarrow FeSO_4+H_2\)
b, \(n_{Fe}=\dfrac{5,6}{56}=0,1\left(mol\right)\)
Theo PT: \(n_{H_2}=n_{Fe}=0,1\left(mol\right)\Rightarrow V_{H_2}=0,1.22,4=2,24\left(l\right)\)
c, \(n_{H_2SO_4}=n_{Fe}=0,1\left(mol\right)\)
\(\Rightarrow C\%_{H_2SO_4}=\dfrac{0,1.98}{200}.100\%=4,9\%=b\)
d, \(n_{FeSO_4}=n_{Fe}=0,1\left(mol\right)\)
Ta có: m dd sau pư = 5,6 + 200 - 0,1.2 = 205,4 (g)
\(\Rightarrow C\%_{FeSO_4}=\dfrac{0,1.152}{205,4}.100\%\approx7,4\%\)
a/ Viết phương trình phản ứng:
Fe + H2SO4 -> FeSO4 + H2
b/ Tỉnh V:
Vì số mol của sắt bằng số mol axit H2SO4, ta có:
5,6 g Fe = một số mol H2SO4 x khối lượng mol Fe 200 g dung dịch H2SO4 = một số mol H2SO4 x khối lượng mol H2SO4
Từ đó, suy ra số mol axit H2SO4 trong dung dịch ban đầu:
n(H2SO4) = 5,6 / (55,85 g/mol) = 0,1 mol
Theo phương trình phản ứng, mỗi mol axit H2SO4 tác dụng với một mol sắt, sinh ra một mol khí H2. Vậy, số mol khí H2 sinh ra trong phản ứng cũng bằng 0,1 mol.
Theo định luật Avogadro, một mol khí ở điều kiện tiêu chuẩn chiếm thể tích là 22,4 lít. Vậy, số lít khí H2 sinh ra trong phản ứng là:
V = 0,1 mol x 22,4 l/mol = 2,241
Vậy, V = 2,24 lít.
c/ Tính B:
• Theo định luật bảo toàn khối lượng, khối lượng của sản phẩm thu được bằng khối lượng của chất đầu vào. Do đó, khối lượng dung dịch sau phản ứng cũng bằng 200 g. o Ta đã tính được số mol H2SO4
trong dung dịch ban đầu là 0,1 mol.
Sau phản ứng, số mol H2SO4 còn
lại trong dung dịch là: n(H2SO4) = n(H2SO4 ban đầu) -
n(H2 sinh ra) = 0,1 - 0,1 = 0 mol
• Vì vậy, dung dịch sau phản ứng chỉ còn chứa FeSO4 và H2O. Khối lượng của FeSO4

nFe=5,6/56=0,1(mol)
Fe+2HCl--->FeCl2+H2
0,1__0,2_____0,1___0,1
mH2=0,1.2=0,2(g)
mdung dịch=5,6+200-0,2=205,4(g)
=>mHCl=>C%HCl
mFeCl2=0,1.127=12,7(g)
=>C%FeCl2=12,7/205,4.100%~6,183%
tính mdung dịch là có công thức hơ
vì răng lại => mHCl => C% HCl
chỗ này mình ko hiểu

\(a,n_{Zn}=\dfrac{19,5}{65}=0,3\left(mol\right)\\ m_{H_2SO_4}=200.19,6\%=39,2\left(g\right)\\ \rightarrow n_{H_2SO_4}=\dfrac{39,2}{98}=0,4\left(mol\right)\)
PTHH: \(Zn+H_2SO_4\rightarrow ZnSO_4+H_2\uparrow\)
bđ 0,3 0,4
pư 0,3 0,3
spư 0 0,1 0,3 0,3
\(\rightarrow V_{H_2}=0,3.22,4=6,72\left(l\right)\)
\(b,m_{dd}=19,5+200-0,3.2=218,9\left(g\right)\\ \rightarrow\left\{{}\begin{matrix}C\%_{ZnSO_4}=\dfrac{0,3.161}{218,9}.100\%=22,06\%\\C\%_{H_2SO_4\left(dư\right)}=\dfrac{0,1.98}{218,9}.100\%=4,48\%\end{matrix}\right.\)

\(n_{Zn}=\dfrac{6,5}{65}=0,1mol\)
a)\(Zn+2HCl\rightarrow ZnCl_2+H_2\)
0,1 0,2 0,1 0,1
b)\(V_{H_2}=0,1\cdot22,4=2,24l\)
c)\(C_{M_{H_2SO_4}}=\dfrac{0,2}{0,2}=1M\)

\(m_{H_2SO_4}=\dfrac{200.9,8}{100}=19,6\left(g\right)\)
\(n_{H_2SO_4}=\dfrac{19,6}{98}=0,2\left(mol\right)\)
PTHH :
\(X+H_2SO_4\rightarrow XSO_4+H_2\)
0,2 0,2 0,2 0,2
\(M_X=\dfrac{8}{0,2}=40\left(dvC\right)\)
-> Canxi
\(b,V_{H_2}=0,2.22,4=4,48\left(l\right)\)
\(c,m_{CaSO_4}=0,2.136=27,2\left(g\right)\)
\(m_{ddCaSO_4}=8+200-\left(0,2.2\right)=207,6\left(g\right)\)
\(C\%=\dfrac{27,2}{207,6}.100\%\approx13,1\%\)
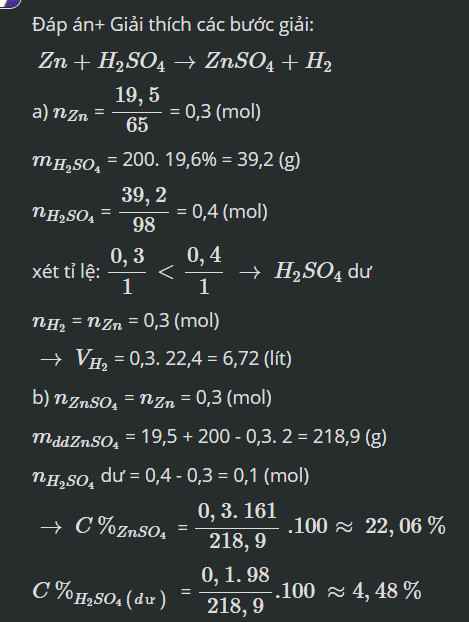
mH2SO4=200.9,8%=19,6(g) -> nH2SO4=19,6/98=0,2(mol)
mKOH=200.5,6%=11,2(g) -> nKOH=11,2/56=0,2(mol)
PTHH: 2 KOH + H2SO4 -> K2SO4 + 2 H2O
Ta có: 0,2/2 < 0,2/1
=> H2SO4 dư, KOH hết, tính theo nKOH
=> Chất có trong dd thu được sau p.ứ: K2SO4 và H2SO4(dư)
nH2SO4(p.ứ)=nK2SO4=1/2. nKOH=1/2. 0,2=0,1(mol)
nH2SO4(dư)=0,2-0,1=0,1(mol) => mH2SO4(dư)=0,1.98=9,8(g)
mK2SO4=174. 0,1=17,4(g)
mddsau= mddH2SO4 + mddKOH= 200+200=400(g)
=>C%ddH2SO4(dư)= (9,8/400).100=2,45%
C%ddK2SO4=(17,4/400).100=4,35%