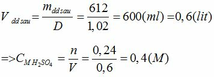Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Giả sử các khí được đo ở điều kiện sao cho 1 mol khí chiếm thể tích V lít
\(n_{N_2}=\dfrac{12}{V}\left(mol\right)\)
\(n_{H_2}=\dfrac{36}{V}\left(mol\right)\)
PTHH: N2 + 3H2 --to,p,xt--> 2NH3
Xét tỉ lệ \(\dfrac{\dfrac{12}{V}}{1}=\dfrac{\dfrac{36}{V}}{3}\) => Hiệu suất có thể tính theo N2 hoặc H2
Gọi số mol N2 pư là a (mol)
PTHH: N2 + 3H2 --to,p,xt--> 2NH3
Trc pư: \(\dfrac{12}{V}\) \(\dfrac{36}{V}\) 0
Pư: a---------->3a---------------2a
Sau pư: \(\left(\dfrac{12}{V}-a\right)\) \(\left(\dfrac{36}{V}-3a\right)\) 2a
=> \(n_{hh\left(saupư\right)}=\left(\dfrac{12}{V}-a\right)+\left(\dfrac{36}{V}-3a\right)+2a=\dfrac{37,2}{V}\)
=> \(a=\dfrac{5,4}{V}\left(mol\right)\)
=> \(H\%=\dfrac{\dfrac{5,4}{V}}{\dfrac{12}{V}}.100\%=45\%\)

Ta có MX = 3,6.2 =7,2.
Áp dụng qui tắc đường chéo :
=> nH2 : nN2 = 4 : 1
Đặt nH2 = 4 mol => nN2 = 1 mol
N2 + 3H2 ---> 2NH3
x----->3x-------->2x
=> nY = 5 – 2x mol
Bảo toàn khối lượng :
mX = mY = 4.2 + 1.28 = 36g
=> MY = 4.2 = \(\dfrac{36}{5-2x}\)
=> x = 0,25 mol
Tính hiệu suất theo N2 => H = \(\dfrac{0,25}{1}\)= 25%

ban đầu nN2+ nH2=500 và nN2/nH2=1/4
=>nN2=100 mol và nH2=400 mol
N2 + 3H2 ---> 2NH3
ban đầu 100 400 0
phản ứng x 3x 2x
sau phản ứng (100-x ) ( 400-3x) 2x
lại có 50=2x=> x=25 => H%=( 25/100). 100%=25%.

1) N2 + 3H2 ------> 2NH3
x -------> 3x -----------> 2x
theo tỉ lệ đề bài chon n(N2) = 1 mol và n(H2) = 3 mol
gọi x là số mol N2 tham gia pứ
ta có pt đại số theo tỉ khối là:
M(A)/MB) = 0,6 <=> (m/4)/(1 - x + 3 - 3x + 2x) = 0,6 (m: khối lượng của hỗn hợp)
=> x = 0,8
H% = 0,8/1 *100 = 80%
2) ( Bạn đã cho thiếu đề rồi. Bây giờ tôi sẽ thêm vào 10 lit H2)
N2 + 3H2 ------> 2NH3

1.
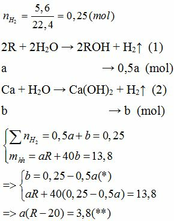
Vì b > 0, từ (*) => a < 0,25/0,5 = 0,5 thế vào (**)
=> R – 20 > 7,6
=> R > 27,6 (***)
Khi cho 8,58 gam R tác dụng với lượng dư HCl thì lượng H2 thoát ra lớn hơn 2,24 (lít)
2R + 2HCl → 2RCl + H2↑ (3)
Theo PTHH (3):
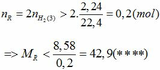
Từ (***) và (****) => 27, 6 < MR < 42,9
Vậy MR = 39 (K) thỏa mãn
2.
Ta có:
=> nKOH = nK = 0,2 (mol)
nCa(OH)2 = nCa = 0,15 (mol)
∑ nOH- = nKOH + 2nCa(OH)2 = 0,2 + 2.0,15 = 0,5 (mol)
Khi cho hỗn hợp Z ( N2, CO2) vào hỗn hợp Y chỉ có CO2 phản ứng
CO2 + OH- → HCO3- (3)
CO2 + 2OH- → CO32- + H2O (4)
CO32- + Ca2+ → CaCO3↓ (5)
nCaCO3 = 8,5/100 = 0,085 (mol) => nCO32-(5) = nCaCO3 = 0,085 (mol)
Ta thấy nCaCO3 < nCa2+ => phương trình (5) Ca2+ dư, CO32- phản ứng hết
TH1: CO2 tác dụng với OH- chỉ xảy ra phản ứng (4)
Theo (4) => nCO2 = nCO32-(4) = nCaCO3 = 0,085 (mol)
=> VCO2(đktc) = 0,085.22,4 = 1,904 (lít)
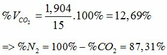
TH2: CO2 tác dụng với OH- xảy ra cả phương trình (3) và (4)
Theo (4): nCO2 = nCO32- = 0,085 (mol)
nOH- (4) = 2nCO32- = 2. 0,085 = 0,17 (mol)
=> nOH- (3)= ∑ nOH- - nOH-(4) = 0,5 – 0,17 = 0,33 (mol)
Theo PTHH (3): nCO2(3) = nOH- = 0,33 (mol)
=> ∑ nCO2(3+4) = 0,085 + 0,33 = 0,415 (mol)
=> VCO2 (ĐKTC) = 0,415.22,4 = 9,296 (lít)
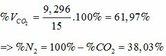

pt N2+3H2--->2NH3
ban đầu 8(l) 25 (l) o
phản ứng x--->3x--->2x
sau 8-x 25-3x 2x
ta có 8-x+25-3x+2x=22,4 ---> x=5,3
từ pt ---> H2 dư nhìu hơn N2 ---> tính H theo N2 ta có 5,3/8=66,25%

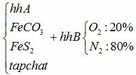
a) Gọi số mol của FeCO3: x (mol) ;
số mol của FeS2: y (mol)
4FeCO3 + O2 → Fe2O3 + 4CO2↑
x → 0,25x → x (mol)
4FeS2 +11O2 → 2Fe2O3 + 8SO2↑
y → 2,75y → 2y (mol)
∑ nO2 = 0,25x + 2,75y (mol)
Cùng điều kiện về nhiệt độ và áp suất nên tỉ lệ về thể tích = tỉ lệ về số mol
=> nN2 = 4nO2 = 4(0,25x + 2,75y)
=> nN2 = x + 11y (mol)
Vậy hỗn hợp Y gồm:
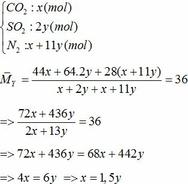
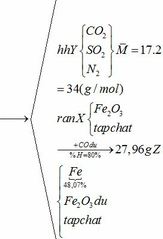
Khối lượng Fe có trong Z là:
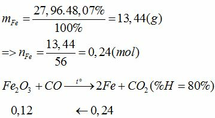
Vì H = 80% => nFe2O3 (trong X) = 0,12. 100% : 80% = 0,15 (mol)
nFe2O3 dư (trong Z) = 0,15 – 0,12 = 0,03 (mol)
Khối lượng tạp chất trong Z = 27,96 – mFe – mFe2O3 dư = 27,96 – 0,24.56 – 0,03.160 = 9,72 (g)
Bảo toàn nguyên tố Fe => nFeCO3 + nFeS2 = 2nFe2O3(trong X)
=> x + y = 0,3 (2)
Từ (1) và (2) => x = 0,18 và y = 0,12 (mol)
Áp dụng công thức PV = nRT ( với n = nCO2 + nSO2 + nN2 = 0,18 + 2. 0,12 + 0,18 +11.0,12 = 1,92)
=> P.10 = 1,92.0,082. (136,5 +273)
=> P = 6,447 ( atm) ≈ 6,5 (atm)
Ta có: mA = mFeCO3 + mFeS2 + mtạp chất = 0,18.116 + 0,12.120 + 9,72 = 45 (g)
![]()
b) hỗn hợp Y gồm:
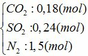
Cho hỗn hợp Y qua O2 ( xúc tác V2O5 ) có phản ứng sau:
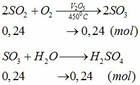
Khối lượng dd sau: mdd sau = mSO3 + mH2O = 0,24. 80 + 592,8 = 612 (g)