Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

\(n_{Fe} = a(mol) ; n_{Mg} = b(mol)\\ \Rightarrow 56a + 24b = 16,8 - 6,4 = 10,4(1)\\ Fe + 2HCl \to FeCl_2 + H_2\\ Mg + 2HCl \to MgCl_2 + H_2\\ n_{H_2} = a + b = \dfrac{6,72}{22,4} = 0,3(2)\)
Từ (1)(2) suy ra: a = 0,1 ; b = 0,2
Vậy :
\(\%m_{Fe} = \dfrac{0,1.56}{16,8}.100\% = 33,33\%\\ \%m_{Mg} = \dfrac{0,2.24}{16,8}.100\% = 28,57\%\\ \%m_{Cu} = 100\% - 33,33\% - 28,57\% = 38,1\%\)

PTHH: Mg + 2HCl → MgCl2 + H2 ↑
Cu + HCl → Không tác dụng
Số mol của Khí H2 là: 3,773 : 22,4 = 0,166652 (mol)
Số mol của Mg là: 0,166652 (mol)
Khối lượng của Mg là: 0,166652 . 24 = 4 gam
% Mg trong hỗn hợp kim loại là: (4:10).100% = 40%
% Cu trong hỗn hợp kim loại là: 100% - 40% = 60%
n H2 = 3.733/ 22,4 = 0,16665 (mol)
Vì Cu không t / d với dung dịch HCl nên lượng H2 sinh ra là của Mg phản ứng .
Mg + 2HCl ---> MgCl2 + H2
theo PTHH : n Mg = n H2 = 0,16665 (mol)
---> m Mg= 0,16665 . 24 = 4(g) ----> %m Mg =( 4 / 10). 100= 40%
----> %m Cu = 100% - 40% = 60%

Gọi số mol của Fe và Cu trong hỗn hợp lần lượt là x và y.
2Fe + 3Cl2 → 2FeCl3 (1)
x(mol) x(mol)
Cu + Cl2 → CuCl2 (2)
y(mol) y(mol)
Fe + 2HCl → FeCl2 + H2 (3)
x (mol) 2x(mol) x(mol).
Theo điều kiện bài toán và phương trình hoá học (3) ta có: 127x = 25,4 → x = 0,2
Theo phương trình phản ứng (1) và (2) ta có: 162,5x + 135y = 59,5
Vậy y = 0,2.
Khối lượng mỗi muối là: m FeCl3=32,5gam
m CuCl2=27gam
%FeCl3 = 54,62%.
%CuCl2 = 45,38%

Ta có: \(n_{HCl}=0,2.2=0,4\left(mol\right)\)
PT: \(Mg+2HCl\rightarrow MgCl_2+H_2\)
Theo PT: \(n_{Mg}=\dfrac{1}{2}n_{HCl}=0,2\left(mol\right)\)
\(\Rightarrow\left\{{}\begin{matrix}\%m_{Mg}=\dfrac{0,2.24}{8}.100\%=60\%\\\%m_{Cu}=100-60=40\%\end{matrix}\right.\)

2Al + 6HCl → 2 A l C l 3 + 3 H 2
a……….3/2.a (mol)
Mg + 2HCl → M g C l 2 + H 2
b....................b (mol)
4 gam rắn không tan là Cu, gọi số mol của Al và Mg lần lượt là a và b (mol). Ta có:
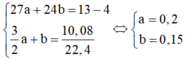
⇒ % m C u = 4 13 .100 = 30,77 % ⇒ % m A l = 0,2.27 13 .100 = 41,54 % ⇒ % m M g = 100 % − 30,77 % − 41,54 % = 27,69 %
⇒ Chọn C.
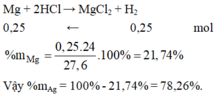
Cu không pư HCl
\(Mg + 2HCl \rightarrow MgCl_2 + H_2\)
\(n_{H_2}=\dfrac{6,72}{22,4}= 0,3 mol\)
Theo PTHH:
\(n_{Mg}= n_{H_2}= 0,3 mol\)
\(\Rightarrow m_{Mg}= 0,3 . 24= 7,2g\)
%m\(Mg\)=\(\dfrac{7,2}{15} . 100\)%= 48%
%m\(Cu\)= 100% - 48%= 52%