Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

a)
$M + 2HCl \to MCl_2 + H_2$
$n_{HCl} = 0,3.1 = 0,3(mol)$
Theo PTHH : $n_M = \dfrac{1}{2}n_{HCl} = 0,15(mol)$
$\Rightarrow M = \dfrac{3,6}{0,15} = 24(Mg)$
b)
$n_{MgCl_2} = n_{Mg} = 0,15(mol)$
$m_{MgCl_2} = 0,15.95 = 14,25(gam)$
c) $n_{H_2} = n_{Mg} = 0,15(mol)$
$V_{H_2} = 0,15.22,4 = 3,36(lít)$

Đáp án B
mNaOH = v.d.C% = 31,25.1,12.16% = 5,6 (gam)
Þ nNaOH = 0,14
Các phản ứng xảy ra theo thứ tự:
2NaOH + H2SO4 g Na2SO4 + 2H2O
Cu(NO3)2 + 2NaOH g Cu(OH)2¯ + 2NaNO3
Cu(OH)2 g CuO + H2O
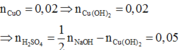
Do đó trong 50ml dung dịch B chứa 0,05 mol H2SO4 và 0,02 mol Cu(NO3)2 .
Khi cho 50ml dung dịch B tác dụng với 0,0375 mol Cu thì:
3Cu+4H2SO4+Cu(NO3)2g4CuSO4+2NO+4H2O
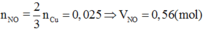

Đáp án B
mNaOH = v.d.C% = 31,25.1,12.16% = 5,6 (gam)
Þ nNaOH = 0,14
Các phản ứng xảy ra theo thứ tự:
2NaOH + H2SO4 g Na2SO4 + 2H2O
Cu(NO3)2 + 2NaOH g Cu(OH)2¯ + 2NaNO3
Cu(OH)2 g CuO + H2O
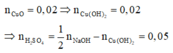
Do đó trong 50ml dung dịch B chứa 0,05 mol H2SO4 và 0,02 mol Cu(NO3)2 .
Khi cho 50ml dung dịch B tác dụng với 0,0375 mol Cu thì:
3Cu+4H2SO4+Cu(NO3)2g4CuSO4+2NO+4H2O
Do đó
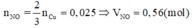

\(n_{Mg}=\dfrac{4,8}{24}=0,2\left(mol\right)\\ a.Mg+2HCl\rightarrow MgCl_2+H_2\\ n_{H_2}=n_{MgCl_2}=n_{Mg}=0,2\left(mol\right)\\ V_{H_2\left(đktc\right)}=0,2.22,4=4,48\left(l\right)\\ b.n_{HCl}=0,2.2=0,4\left(mol\right)\\ m_{ddHCl}=\dfrac{0,4.36,5.100}{7,3}=200\left(g\right)\\ c.m_{ddsau}=4,8+200-0,2.2=204,4\left(g\right)\\ C\%_{ddMgCl_2}=\dfrac{0,2.95}{204,4}.100\approx9,295\%\\ d.V_{ddHCl}=\dfrac{200}{1,05}=\dfrac{4000}{21}\left(ml\right)=\dfrac{4}{21}\left(l\right)\\ C_{MddHCl}=\dfrac{0,4}{\dfrac{4}{21}}=2,1\left(M\right)\)

số mol kẽm tham gia phản ứng là:\(n_{Zn}=\frac{m}{M}=\frac{6,5}{65}=0,1\left(mol\right)\)
PTHH:
\(Zn+2HCl\rightarrow ZnCl_2+H_2\)
0,1 0,2 0,1 (mol)
a, thể tích khí hiđro thu được là:\(V_{H_2}=n_{H_2}\times22,4=0,1\times22,4=2,24\left(l\right)\)
b,khối lượng HCl cần dùng là:\(m_{HCl}=n_{HCl}\times M=0,2\times65=13\left(g\right)\)

PT: \(Fe+2HCl\rightarrow FeCl_2+H_2\)
Ta có: \(n_{Fe}=\dfrac{11,2}{56}=0,2\left(mol\right)\)
Theo PT: \(\left\{{}\begin{matrix}n_{H_2}=n_{FeCl_2}=n_{Fe}=0,2\left(mol\right)\\n_{HCl}=2n_{Fe}=0,4\left(mol\right)\end{matrix}\right.\)
a, Ta có: \(V_{H_2}=0,2.22,4=4,48\left(l\right)\)
b, \(V_{ddHCl}=\dfrac{0,4}{1,5}\approx0,267\left(l\right)\)
c, \(m_{FeCl_2}=0,2.127=25,4\left(g\right)\)
Bạn tham khảo nhé!

Đề bài phải là thể tích CO2 bạn nhé!
a, PT: \(CaCO_3+2HCl\rightarrow CaCl_2+H_2O+CO_2\)
Ta có: \(n_{CaCO_3}=\dfrac{4}{100}=0,04\left(mol\right)\)
\(m_{HCl}=\dfrac{14,6.25}{100}=3,65\left(g\right)\Rightarrow n_{HCl}=\dfrac{3,65}{36,5}=0,1\left(mol\right)\)
Xét tỉ lệ: \(\dfrac{0,04}{1}< \dfrac{0,1}{2}\), ta được HCl dư.
Theo PT: \(n_{CO_2}=n_{CaCO_3}=0,04\left(mol\right)\)
\(\Rightarrow V_{CO_2}=0,04.22,4=0,896\left(l\right)\)
b, Theo PT: \(\left\{{}\begin{matrix}n_{HCl\left(pư\right)}=2n_{CaCO_3}=0,08\left(mol\right)\\n_{CaCl_2}=n_{CaCO_3}=0,04\left(mol\right)\end{matrix}\right.\)
\(\Rightarrow n_{HCl\left(dư\right)}=0,02\left(mol\right)\Rightarrow m_{HCl\left(dư\right)}=0,02.36,5=0,73\left(g\right)\)
\(m_{CaCl_2}=0,04.111=4,44\left(g\right)\)
Bạn tham khảo nhé!
PTHH: \(CaCO_3+2HCl\rightarrow CaCl_2+H_2O+CO_2\uparrow\)
Ta có: \(\left\{{}\begin{matrix}n_{CaCO_3}=\dfrac{4}{100}=0,04\left(mol\right)\\n_{HCl}=\dfrac{14,6\cdot25\%}{36,5}=0,1\left(mol\right)\end{matrix}\right.\)
Xét tỉ lệ: \(\dfrac{0,04}{1}< \dfrac{0,1}{2}\) \(\Rightarrow\) HCl còn dư, CaCO3 p/ứ hết
\(\Rightarrow\left\{{}\begin{matrix}n_{CO_2}=n_{CaCl_2}=0,04\left(mol\right)\\n_{HCl\left(dư\right)}=0,02\left(mol\right)\end{matrix}\right.\) \(\Rightarrow\left\{{}\begin{matrix}V_{CO_2}=0,04\cdot22,4=0,896\left(l\right)\\m_{CaCl_2}=0,04\cdot111=4,44\left(g\right)\\m_{HCl\left(dư\right)}=0,02\cdot36,5=0,73\left(g\right)\end{matrix}\right.\)




a)\(n_{Fe}:\dfrac{14}{56}=0,25\left(mol\right)\)
\(Fe+H_2SO_4\rightarrow FeSO_4+H_2\)
1................................1,,,,,,,,,,,,1(mol)
0,25...........................0,25......0,25(mol)
\(V_{H_2}:0,25.22,4=5,6\left(l\right)\)
b)
\(m_{FeSO_4}:0,25.152=38\left(g\right)\)
c)
\(CuO+H_2\underrightarrow{t^o}Cu+H_2O\)
1...............1........1..............(mol)
0,25.........0,25,,,,0,25..........(mol)
\(m_{Cu}:0,25.64=16\left(g\right)\)