Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

PT: \(Zn+H_2SO_4\rightarrow ZnSO_4+H_2\)
a, Ta có: \(n_{Zn}=\dfrac{6,5}{65}=0,1\left(mol\right)\)
\(n_{H_2SO_4}=0,2.1=0,2\left(mol\right)\)
Xét tỉ lệ: \(\dfrac{0,1}{1}< \dfrac{0,2}{1}\). ta được H2SO4 dư.
Theo PT: \(n_{H_2SO_4\left(pư\right)}=n_{ZnSO_4}=n_{Zn}=0,1\left(mol\right)\)
\(\Rightarrow n_{H_2SO_4\left(dư\right)}=0,2-0,1=0,1\left(mol\right)\)
b, Ta có: \(m_{ZnSO_4}=0,1.161=16,1\left(g\right)\)
c, \(C_{M_{H_2SO_4\left(dư\right)}}=\dfrac{0,1}{0,2}=0,5M\)
\(C_{M_{ZnSO_4}}=\dfrac{0,1}{0,2}=0,5M\)
Bạn tham khảo nhé!

a) Zn + 2HCl → ZnCl2 + H2↑
b) \(n_{Zn}=\dfrac{13}{65}=0,2\left(mol\right)\)
Theo PT: \(n_{H_2}=n_{Zn}=0,2\left(mol\right)\)
\(\Rightarrow V_{H_2}=0,2\times22,4=4,48\left(l\right)\)
c) Theo PT: \(n_{HCl}=2n_{Zn}=2\times0,2=0,4\left(mol\right)\)
\(\Rightarrow C_{M_{HCl}}=\dfrac{0,4}{0,2}=2\left(M\right)\)

1, \(n_{NaOH}=0,3.1+1,5.0,2=0,6\left(mol\right)\)
\(V_{NaOH}=0,2+0,3=0,5\left(l\right)\)
\(\rightarrow\left\{{}\begin{matrix}C_{MNaOH}=\dfrac{0,6}{0,5}=1,2M\\C\%=1,2.\dfrac{40}{10.1,05}=4,57\%\end{matrix}\right.\)
2, \(m_{H_2SO_4}=200.9,8\%=19,6\left(g\right)\\ m_{ddH_2SO_4\left(39,2\%\right)}=\dfrac{19,6}{39,2\%}=50\left(g\right)\\ \rightarrow m_{H_2O\left(thêm\right)}=200-50=150\left(g\right)\)
Cách pha: ta cân lấy 50 g ddH2SO4 39,2% và 150 g H2O, rót nước vào bình ống nghiệm rồi từ từ rót ddH2SO4 vào rồi khuấy đều

1)
a) nZn = 0,2 mol
nHCl = 0,2 mol
Zn (0,1) + 2HCl (0,2) -----> ZnCl2 (0,1) + H2 (0,1)
- Theo PTHH: nH2 = 0,1 mol
=> VH2 = 2,24 lít
b) - Theo PTHH: nZnCl2 = 0,1 mol
=> mZnCl2 = 13,6 gam
c) CM ZnCl2 = \(\dfrac{0,1}{0,2}=0,5M\)

nZn = \(\dfrac{6,5}{65}=0,1\) mol
nH2SO4 = 1 . 0,2 = 0,2 mol
Pt: Zn + H2SO4 --> ZnSO4 + H2
0,1 mol-------------> 0,1 mol-> 0,1 mol
Xét tỉ lệ mol giữa Zn và H2SO4;
\(\dfrac{0,1}{1}< \dfrac{0,2}{1}\)
Vậy H2SO4 dư
VH2 thu được = 0,1 . 22,4 = 2,24 (lít)
CM ZnSO4 = \(\dfrac{0,1}{0,2}=0,5M\)

\(1.3NaOH+H_3PO_4\rightarrow Na_3PO_4+3H_2O\\ a=n_{H_3PO_4}=\dfrac{1}{3}n_{NaOH}=\dfrac{1}{3}\cdot0,9=0,3mol\\ \Rightarrow A\\ 2.n_{Ba\left(OH\right)_2}=0,2.0,4=0,08mol\\ n_{H_2SO_4}=0,25.0,3=0,075mol\\ Ba\left(OH\right)_2+H_2SO_4\rightarrow BaSO_4+2H_2O\\ \Rightarrow\dfrac{0,08}{1}>\dfrac{0,075}{1}\Rightarrow Ba\left(OH\right)_2.dư\\ n_{BaSO_4}=n_{H_2SO_4}=0,075mol\\ m_{\uparrow}=m_{BaSO_4}=0,075.233=16,725g\\ \Rightarrow?:))\\ 3.n_{KOH}=0,2.1=0,2mol\\ n_{H_2SO_4}=0,2.1=0,2mol\\ 2KOH+H_2SO_4\rightarrow K_2SO_4+2H_2O\\ \Rightarrow\dfrac{0,2}{2}< \dfrac{0,2}{1}\Rightarrow H_2SO_4.dư\\ n_{H_2SO_4.pư}=\dfrac{1}{2}n_{KOH}=\dfrac{1}{2}\cdot0,2=0,1mol\\ n_{H_2SO_4_4.dư}=0,2-0,1mol\\ H_2SO_4+Mg\rightarrow MgSO_4+H_2\\ n_{H_2}=n_{H_2SO_4.dư}=0,1mol\\ V_{H_2}=0,1.24,79=2,479l\\ \Rightarrow A\)

`n_[Zn]=13/65=0,2(mol)`
`Zn + 2HCl -> ZnCl_2 + H_2 \uparrow`
`0,2` `0,4` `0,2` `(mol)`
`a)V_[H_2]=0,2.22,4=4,48(l)`
`b)C%_[HCl]=[0,4.36,5]/150 .100~~9,73%`
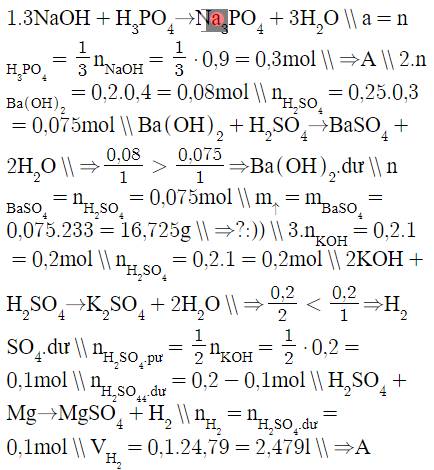
Cho 13g Zn vào 200ml dung dịch H2SO4 1,5M ( D= 1,05g/mol)
a) Tính CM dung dịch thu được ( Xem V không đổi )
b) Tính C% dung dịch sau phản ứng
--
a) nZn= 0,2(mol)
nH2SO4= 1,5.0,2= 0,3(mol)
PTHH: Zn + H2SO4 -> ZnSO4 + H2
Ta có: 0,3/1 > 0,2/1
=> Zn hết, H2SO4 dư, tính theo nZn
nZnSO4= nZn=nH2= 0,2(mol)
VddZnSO4= VddH2SO4= 0,2(l)
=> CMddZnSO4= 0,2/0,2= 1(M)
b) mddH2SO4=DddH2SO4.VddH2SO4= 1,05.200= 210(g)
=> mddZnSO4= mZn + mddH2SO4 - mH2= 13+210-0,2.2= 222,6(g)
=> \(C\%ddZnSO4=\frac{mZnSO4}{mddZnSO4}.100\%=\frac{0,2.161}{222,6}.100\approx14,465\%\)
Em xem lại cách tính!