Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

a) $Zn + 2HCl \to ZnCl_2 + H_2$
b) Chất phản ứng : $Zn,HCl$
Sản phẩm : $ZnCl_2,H_2$
Tỉ lệ số nguyên tử Zn : Số phân tử $HCl$ là 2 : 1
Tỉ lệ số phân tử $ZnCl_2$ : số phân tử $H_2$ là 1 : 1
c) $m_{Zn} + m_{HCl} = m_{ZnCl_2} + m_{H_2}$
d) $m_{H_2} = 26 + 29,2 - 54,4 = 0,8(gam)$
e) 1 đvC = $\dfrac{1,9926.10^{-23}}{12} = 1,6605.10^{-24}(gam)$
$m_H = 1.1,6605.10^{-24} = 1,6605.10^{-24}(gam)$
$m_{Zn} = 65.1,6605.10^{-24} = 107,9325.10^{-24}(gam)$
f)$n_{H_2} = 0,4(mol) ; n_{CO_2} = \dfrac{0,44}{44} = 0,01(mol)$
$\Rightarrow n_{hh} = 0,4 + 0,01 = 0,41(mol)$
$V_{hh} = 0,41.22,4 = 9,184(lít)$

\(PTHH:Zn+2HCl->ZnCl_2+H_2\)
ap dung DLBTKL ta co
\(m_{Zn}+m_{HCl}=m_{ZnCl_2}+m_{H_2}\)
\(=>m_{H_2}=m_{Zn}+m_{HCl}-m_{ZnCl_2}\\ =>m_{H_2}=13+14,6-27,2\\ =>m_{H_2}=0,4\left(g\right)\)

a) Zn+2HCl--.ZnCl2+H2
b) Áp dụng định luật bảo toàn khôi lượng ta có
m Zn+ m HCl =m ZnCl2+ m H2
=> m ZnCl2=m Zn+m HCl-m H2
=6,5+7,3-0,2=13,6(g)

a) Lập công thức hóa học của muối kẽm clorua: Z n C l 2
b) Khối lượng muối Z n C l 2 = 6,5 + 7,3 – 0,2 = 13,6 (gam)

\(a,PTHH:Zn+2HCl\to ZnCl_2+H_2\)
Phản ứng thế
\(b,n_{Zn}=\dfrac{1,3}{65}=0,02(mol)\\ \Rightarrow n_{ZnCl_2}=n_{H_2}=0,02(mol)\\ \Rightarrow m_{ZnCl_2}=0,02.136=2,72(g)\\ V_{H_2}=0,02.22,4=0,448(l)\)

\(n_{Zn}=\dfrac{13}{65}=0,2\left(mol\right);n_{H_2}=\dfrac{2,24}{22,4}=0,1\left(mol\right)\\a, Zn+2HCl\rightarrow ZnCl_2+H_2\\ b,V\text{ì}:\dfrac{0,2}{1}>\dfrac{0,1}{1}\Rightarrow Zn\text{dư}\\ \Rightarrow n_{Zn\left(p.\text{ứ}\right)}=n_{ZnCl_2}=n_{H_2}=0,1\left(mol\right)\\b, m_{Zn\left(p.\text{ứ}\right)}=0,1.65=6,5\left(g\right)\\ n_{HCl}=0,1.2=0,2\left(mol\right)\\ m_{HCl}=0,2.36,5=7,3\left(g\right)\\ d,m_{ZnCl_2}=136.0,1=13,6\left(g\right)\)

nZn= 0,2 mol
a) Zn + 2HCl → ZnCl2 + H2↑
0,2 mol 0,4 mol 0,2 mol 0,2 mol
b) mZnCl2= 0,2x 136= 27,2 (g)
c) mHCl= 0,4x36,5= 14,6 (g)
a)Zn+2Hcl=>ZnCl2+H2
b)nZn=13/65=0,2 mol
Zn+2Hcl=>ZnCl2+H2
0.2=>0,4=>0,2=>0,2 (mol)
b)mZnCl2=0,2.(65+35,5.2)=27,2g
c)mHcl=0,4*(1+35,5)=14,6g

a) Zn+2HCl-->ZnCl2+H2
b) Theo định luật bảo toàn khối lượng ta có công thức sau
m\(_{ZnCl2}+m_{H2}=m_{Zn}+m_{HCl}\)
c) Ta có
m\(_{H2}=m_{Zn}+m_{HCl}-m_{ZnCl2}\)
=\(13-14,6-27,2=0,4\left(g\right)\)
a) PTHH: Zn + 2 HCl -> ZnCl2 + H2
b) CT về khối lượng: \(m_{Zn}+m_{HCl}=m_{ZnCl_2}+m_{H_2}\)
c) => \(m=m_{H_2}=m_{Zn}+m_{HCl}-m_{ZnCl_2}\\ =13+14,6-27,2=0,4\left(g\right)\)
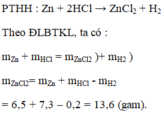
a) Zn + 2HCl\(\rightarrow\)ZnCl2 + H2
b)
BTKL: mZn+mHCl=mZnCl+ mH2
\(\rightarrow\)mZnCl2=mZn + mHCl-mH2
=13+14,6-0,4=27,2 gam
c)
Tỉ lệ Zn:HCl:ZnCl2:H2=1:2:1:1
Zn : H:Cl=1:2:2
a) Zn + 2HCl→→ZnCl2 + H2
b)
BTKL: mZn+mHCl=mZnCl+ mH2
→→mZnCl2=mZn + mHCl-mH2
=13+14,6-0,4=27,2 gam
ti le 1:2:2