Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Chọn A
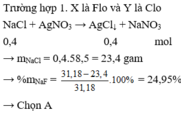
Chú ý: Với đề trắc nghiệm chọn được đáp án A có thể không cần xét thêm trường hợp 2.
Trường hợp 2. X khác Flo. Gọi hỗn hợp (NaX, NaY) tương đương với NaM


Zn + 2HCl => ZnCl2 + H2
Na2CO3 + 2HCl=> 2NaCl + H2O + CO2
MY = 0,5875.32 = 18,8
áp dụng sơ đồ đường chéo ta đc nH2 : nCO2 = 3:2
mà nH2 = nZn ; nCO2 = nNa2CO3
=> nZn = 3/2 nCO2
ta có \(65.\frac{3}{2}x+106x=4,07\left(g\right)\) => x= 0,02 mol => nZn =0,03
a. => % na2CO3 = \(\frac{0,02.106}{4,07}.100\%=52,088\%\)
=> % Zn = 47,912%
b. nHCl pư = 2 .nZn + 2. nNa2CO3 = 2.0,03+ 2.0,02 = 0,1
=> mHCl pư = 0,1.36,5 = 3,65 (g)
=> m HCl dùng = 3,65.120% = 4,38 (g)
=> mdd HCl = \(\frac{4,38.100}{25}=17,52\)
=> mdd = 4,07 + 17,52 - 0,03.2-0,02.44 = 20,65(g)
mHCl dư = 4,38 - 3,65 = 0,73(g)
C% HCl dư = \(\frac{0,73}{20,65}.100\%\) = 3,535%

\(n_A=0,15\left(mol\right)\)
- Giả sử HX là HF (ko tạo kết tủa) \(\Rightarrow\) HY là HCl
\(AgNO_3+2HCl\rightarrow AgCl+HNO_3\)
\(\Rightarrow n_{HCl}=2n_{AgCl}=\frac{25,53}{143,5}=0,178\left(mol\right)>0,15\left(mol\right)\) ( Loại )
- Giả sử HX HY đều tạo kết tủa. Gọi chung là HR
\(HR+AgNO_3\rightarrow AgR+HNO_3\)
\(\Rightarrow n_{AgR}=n_{HR}=0,15\left(mol\right)\)
\(\Rightarrow M_{AgR}=\frac{25,53}{0,15}=170,2\)
\(\Rightarrow M_R=170,2-108=62,2\Rightarrow Cl,Br\)
Vậy X là Cl; Y là Br
Gọi a là mol HCl, b là mol HBr
n hidro halogenua = n kết tủa
\(\left\{{}\begin{matrix}a+b=0,15\\143,5a+188b=25,53\end{matrix}\right.\Rightarrow\left\{{}\begin{matrix}a=0,06\\b=0,09\end{matrix}\right.\)
\(\Rightarrow\%m_{HCl}=\frac{0,06.36,5.100}{0,06.36,5+0,09.81}=23,1\%\)
\(\Rightarrow\%m_{HBr}=100\%-23,1\%=76,9\%\)

- Nếu một trong 2 muối là NaF => Muối còn lại là NaCl
\(n_{AgCl}=\dfrac{68,306}{143,5}=0,476\left(mol\right)\)
PTHH: NaCl + AgNO3 --> NaNO3 + AgCl
0,476<-----------------------0,476
=> mNaCl = 0,476.58,5 = 27,846(g)
=> mNaF = 35,411 - 27,846 = 7,565(g)
- Nếu trong A không có NaF
=> Gọi công thức của 2 muối là NaX
=> \(n_{NaX}=\dfrac{35,411}{23+M_X}\left(mol\right)\)
PTHH: NaX + AgNO3 --> NaNO3 + AgX
\(\dfrac{35,411}{23+M_X}\)----------------->\(\dfrac{35,411}{23+M_X}\)
=> \(\dfrac{35,411}{23+M_X}=\dfrac{68,306}{108+M_X}\)
=> \(M_X=68,5\)
=> 2 muối là NaCl, NaBr
Gọi số mol của NaCl, NaBr là a, b
=> 58,5a + 103b = 35,411
PTHH: NaCl + AgNO3 --> AgCl + NaNO3
a------------------>a
NaBr + AgNO3 --> AgBr + NaNO3
b------------------->b
=> 143,5a + 188b = 68,306
=> a = 0,1; b = 0,287
=> \(\left\{{}\begin{matrix}m_{NaCl}=0,1.58,5=5,85\left(g\right)\\m_{NaBr}=0,287.103=29,561\left(g\right)\end{matrix}\right.\)

a) Giả sử MX < MY
TH1: Nếu trong hỗn hợp có NaF
=> muối còn lại là NaCl
\(n_{AgCl}=\dfrac{57,4}{143,5}=0,4\left(mol\right)\)
=> nNaCl = 0,4 (mol)
=> mNaCl = 0,4.58,5 = 23,4 (g)
\(\%m_{NaCl}=\dfrac{23,4}{31,9}.100\%=73,35\%\)
\(\%m_{NaF}=\dfrac{31,9-23,4}{31,9}.100\%=26,65\%\)
TH2: Nễu trong hh không có NaF
Gọi công thức chung của 2 muối là NaZ
\(n_{AgZ}=\dfrac{57,4}{108+M_Z}\left(mol\right)\)
=> \(n_{NaZ}=\dfrac{31,9}{23+M_Z}=\dfrac{57,4}{108+M_Z}\)
=> MZ = 83,333 (g/mol)
=> NaX, NaY lần lượt là NaBr, NaI
Gọi \(\left\{{}\begin{matrix}n_{NaBr}=a\left(mol\right)\\n_{NaI}=b\left(mol\right)\end{matrix}\right.\)
=> 103a + 150b = 31,9 (1)
\(\left\{{}\begin{matrix}n_{AgBr}=a\left(mol\right)\\n_{AgI}=b\left(mol\right)\end{matrix}\right.\)
=> 188a + 235b = 57,4 (2)
(1)(2) => \(\left\{{}\begin{matrix}a=\dfrac{131}{470}\left(mol\right)\\b=\dfrac{1}{47}\left(mol\right)\end{matrix}\right.\)
\(\left\{{}\begin{matrix}\%m_{NaBr}=\dfrac{\dfrac{131}{470}.103}{31,9}.100\%=90\%\\\%m_{NaI}=\dfrac{\dfrac{1}{47}.150}{31,9}.100\%=10\%\end{matrix}\right.\)
b)
TH1: Nếu là NaF và NaCl
- Cho các dd tác dụng với dd AgNO3:
+ Không hiện tượng: NaF
+ Kết tủa trắng: NaCl
NaCl + AgNO3 --> NaNO3 + AgCl
TH2: Nếu là NaBr và NaI
- Cho các dd tác dụng với dd AgNO3:
+ Kết tủa vàng nhạt: NaBr
NaBr + AgNO3 --> AgBr + NaNO3
+ Kết tủa vàng: NaI
NaI + AgNO3 --> AgI + NaNO3

1.
Gọi CT chung của 2 kim loại là M
M + 2HCl --> MCl2 + H2 (1)
MCl2 +2AgNO3 --> M(NO3)2 + 2AgCl (2)
nM=\(\dfrac{8,8}{M_M}\)(mol)
theo (1) : nAgNO3=2nM=\(\dfrac{17,6}{M_M}\left(mol\right)\)
Khi thêm 0,5 mol AgNO3 thì không kết tủa hết , còn khi thêm 0,7 mol AgNO3 vào dd D thì AgNO3 dư
=> 0,5 < \(\dfrac{17,6}{M_M}\)< 0,7 => 25,14 < MM<35,2
=> 2 kim loại lần lượt là Na và K
2.
a) Gọi CT chung của 2 muối natri của 2 halogen là NaX
NaX + AgNO3 --> NaNO3 + AgX (1)
nNaX=\(\dfrac{22}{23+M_X}\)(mol)
nAgX=\(\dfrac{47,5}{108+M_X}\)(mol)
Theo (1) :nNaX=nAgX => \(\dfrac{22}{23+M_X}=\dfrac{47,5}{108+M_X}\)
=> MX=50,33(g/mol)
=> 2 halogen là : Cl2 và Br2
b) Gía sử có x mol NaCl
y mol NaBr
=> \(\left\{{}\begin{matrix}58,5x+103y=22\\143,5x+188y=47,5\end{matrix}\right.=>\left\{{}\begin{matrix}x=0,2\left(mol\right)\\y=0,1\left(mol\right)\end{matrix}\right.\)
=> mNaCl=11,7(g)
mNaBr=10,3(g)

Đáp án D
Trường hợp 1: Hai halogen đều tạo được kết tủa với AgNO3
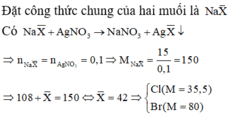
Do đó hai muối trong X là NaCl và NaBr
Trường hợp 2: Hai muối là NaF và NaCl
Phản ứng tạo thành kết tủa chỉ có AgCl và AgF là muối tan:
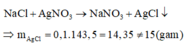
Do đó trường hợp này không thỏa mãn.

BTKL: mNa + mX2 = m muối \(\rightarrow\) mNa = 17,04 - 12,44 = 4,6 gam \(\rightarrow\) nNa = 0,2 mol
2Na + X2 \(\rightarrow\)2NaX
0,2_________0,2
Ta có: 0,2. (23+X) = 17,04 \(\rightarrow\) X = 62,2 \(\rightarrow\)2 halogen là clo và brom
Gọi số mol của NaCl và NaBr lần lượt là a, b mol
BTNT \(\rightarrow\) nNaCl = 2a; nNaBr = 2b
Ta có hệ phương trình: 71a +160b = 12,44 (1); 58,5. 2a + 103. 2b = 17,04 (2)
\(\rightarrow\) a = 0,04; b = 0,06
%m NaCl = 18,8%
BTKL: mNa + mX2 = m muối => mNa = 17,04 - 12,44 = 4,6 gam => nNa = 0,2 mol
2Na + X2 -> 2NaX
mol 0,2 ->0,2
Ta có: 0,2. (23+X) = 17,04 => X = 62,2 => 2 halogen là clo và brom
Gọi số mol của NaCl và NaBr lần lượt là a, b mol
BTNT => nNaCl = 2a; nNaBr = 2b
Ta có hệ phương trình: 71a +160b = 12,44 (1); 58,5. 2a + 103. 2b = 17,04 (2)
=> a = 0,04; b = 0,06
%m Cl2 = (0,04. 71. 100): 12,44 =22,82%