

Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

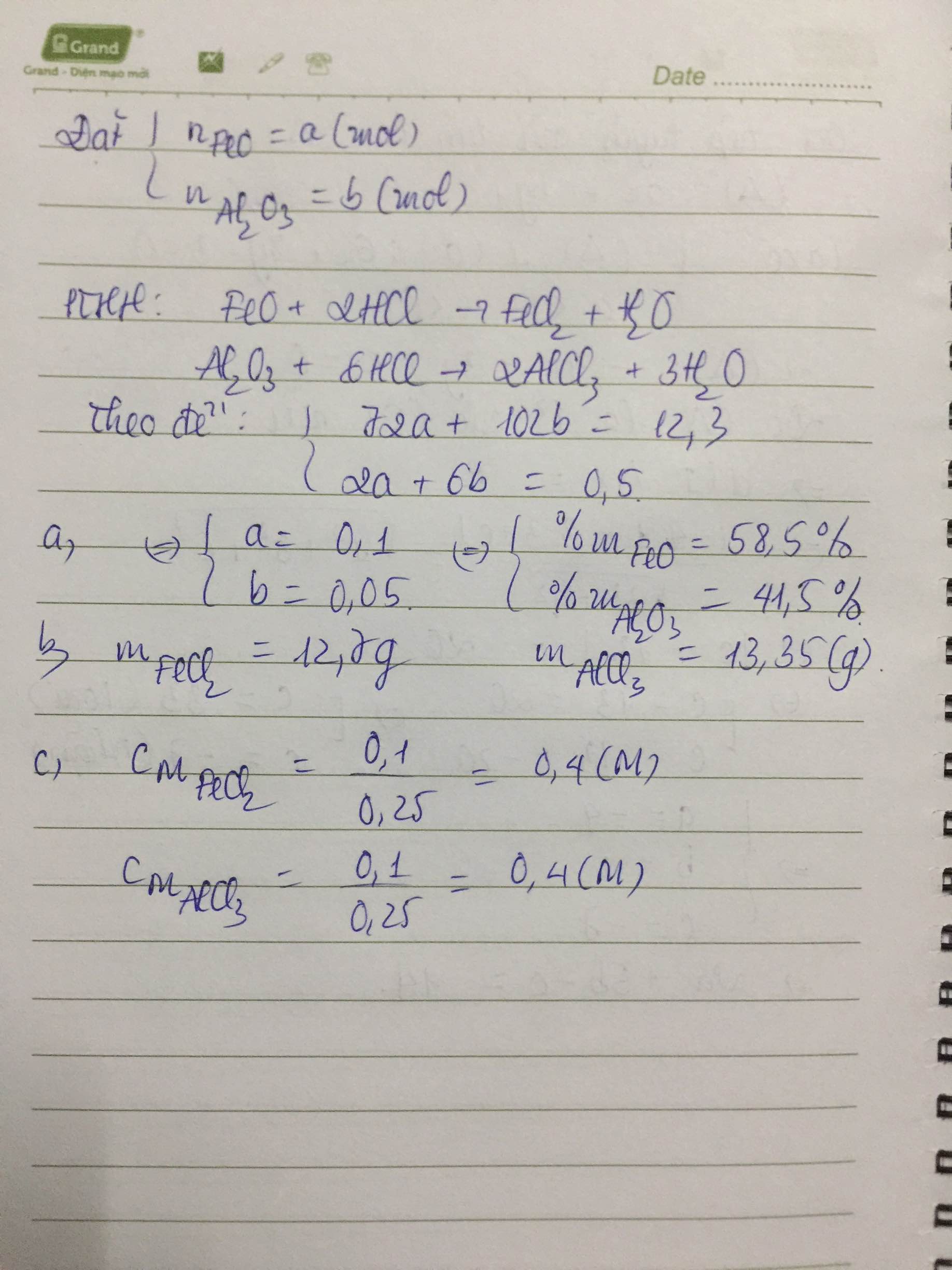


PTHH: \(FeO+2HCl\rightarrow FeCl_2+H_2O\)
x______2x______x______x (mol)
\(Al_2O_3+6HCl\rightarrow2AlCl_3+3H_2O\)
y______6y______2y_______3y (mol)
a) Ta lập HPT: \(\left\{{}\begin{matrix}72x+102y=12,3\\2x+6y=0,25\cdot2=0,5\end{matrix}\right.\) \(\Leftrightarrow\left\{{}\begin{matrix}x=0,1\\y=0,05\end{matrix}\right.\)
\(\Rightarrow\left\{{}\begin{matrix}\%m_{FeO}=\dfrac{0,1\cdot72}{12,3}\cdot100\%\approx58,54\%\\\%m_{Al_2O_3}=41,46\%\end{matrix}\right.\)
b) Theo PTHH: \(n_{FeCl_2}=0,1\left(mol\right)=n_{AlCl_3}\)
\(\Rightarrow m_{muối}=0,1\cdot127+0,1\cdot133,5=26,05\left(g\right)\)

\(n_{MgO}=a\left(mol\right),n_{Fe_2O_3}=b\left(mol\right)\)
\(m=40a+160b=12\left(g\right)\left(1\right)\)
\(MgO+H_2SO_4\rightarrow MgSO_4+H_2O\)
\(Fe_2O_3+3H_2SO_4\rightarrow Fe_2\left(SO_4\right)_3+3H_2O\)
\(m_{Muối}=120a+400y=32\left(g\right)\left(2\right)\)
\(\left(1\right),\left(2\right):a=0.1,b=0.05\)
\(\%MgO=\dfrac{0.1\cdot40}{12}\cdot100\%=33.33\%\)
\(\%Fe_2O_3=66.67\%\)
\(m_{dd}=12+200=212\left(g\right)\)
\(C\%_{MgSO_4}=\dfrac{0.1\cdot120}{212}\cdot100\%=5.66\%\)
\(C\%_{Fe_2\left(SO_4\right)_3}=\dfrac{0.05\cdot400}{212}\cdot100\%=9.42\%\)

\(n_{H_2SO_4}=0,2.2=0,4\left(mol\right)\)
Fe + H2SO4 → FeSO4 + H2
2Al + 3H2SO4 → Al2(SO4)3 + 3H2
Gọi x,y lần lượt là số mol Fe, Al
\(\left\{{}\begin{matrix}56x+27y=11\\x+\dfrac{3}{2}y=0,4\end{matrix}\right.\)
\(\Rightarrow\left\{{}\begin{matrix}x=0,1\\y=0,2\end{matrix}\right.\)
=>\(\%m_{Fe}=\dfrac{0,1.56}{11}.100=50,91\%\)
=> %m Al = 100 - 50,91 =49,09 %
b)Theo PT: \(n_{H_2}=n_{H_2SO_4}=0,4\left(mol\right)\)
=> \(V_{H_2}=0,4.22,4=8,96\left(l\right)\)
c) \(CM_{FeSO_4}=\dfrac{0,1}{0,2}=0,5M\)
\(CM_{Al_2\left(SO_4\right)_3}=\dfrac{\dfrac{0,2}{2}}{0,2}=0,5M\)

Pt : CuO + 2HCl → CuCl2 + H2O\(|\)
1 2 1 1
a 2a 0,1
Fe2O3 + 6HCl → 2FeCl3 + 3H2O\(|\)
1 6 2 3
b 6b 0,1
a) Theo đề ta có : mCuO + mFe2O3 = 16 (g)
⇒ nCuO . MCuO + nFe2O3 . MFe2O3 = 16 g
⇒ 80a + 160b = 16 g (1)
Khối lượng của axit clohidric
C0/0HCl = \(\dfrac{m_{ct}.100}{m_{dd}}\Rightarrow m_{ct}=\dfrac{C.m_{dd}}{100}=\dfrac{10.182,5}{100}=18,25\left(g\right)\)
Số mol của axit clohidirc
nHCl =\(\dfrac{m_{HCl}}{M_{HCl}}=\dfrac{18,25}{36,5}=0,5\left(mol\right)\)
⇒ 2a + 6b = 0,5 (2)
Từ (1),(2) , ta có hệ phương trình :
80a + 160b = 16
2a + 6b = 0,5
⇒ \(\left\{{}\begin{matrix}a=0,1\\b=0,05\end{matrix}\right.\)
Khối lượng của đồng (II) oxit
mCuO = nCuO . MCuO
= 0,1 . 80
= 8 (g)
Khối lượng của sắt (III) oxit
mFe2O3 = nFe2O3 . MFe2O3
= 0,05 . 160
= 8 (g)
0/0CuO = \(\dfrac{m_{CuO}.100}{m_{hh}}=\dfrac{8.100}{16}=50\)0/0
0/0Fe2O3 = \(\dfrac{m_{Fe2O3}.100}{m_{hh}}=\dfrac{8.100}{16}=50\)0/0
b) Có nCuO = 0,1 mol ⇒ nCuCl2 = 0,1 mol
nFe2O3 = 0,05 mol ⇒ nFeCl3 = 0,1 mol
Khối lượng của muối đồng (II) clorua
mCuCl2 = nCuCl2 . MCuCl2
= 0,1 . 135
= 13,5 (g)
khối lượng của muối sắt (III) clorua
mFeCl3 = nFeCl3 . MFeCl3
= 0,1 . 162,5
= 16,25 (g)
Khối lượng của dung dịch sau phản ứng
mdung dịch sau phản ứng = (mCuO + mFe2O3) + HCl
= 16 + 182,5
= 198,5 (g)
Nồng độ phàn trăm của muối đồng (II) clorua
C0/0CuCl2 = \(\dfrac{m_{ct}.100}{m_{dd}}=\dfrac{13,5.100}{198,5}=6,80\)0/0
Nồng đọ phàn trăm của muối sắt (III) clorua
C0/0FeCl3 = \(\dfrac{m_{ct}.100}{m_{dd}}=\dfrac{16,25.100}{198,5}=8,19\)0/0
Chúc bạn học tốt

PTHH: \(Fe+H_2SO_4\rightarrow FeSO_4+H_2\)
a_______a_______a_____a (mol)
\(2Al+3H_2SO_4\rightarrow Al_2\left(SO_4\right)_3+3H_2\uparrow\)
2b______3b__________b_____3b (mol)
Ta lập HPT: \(\left\{{}\begin{matrix}56a+27\cdot2b=11\\a+3b=0,2\cdot2=0,4\end{matrix}\right.\) \(\Leftrightarrow\left\{{}\begin{matrix}a=0,1\\b=0,1\end{matrix}\right.\)
\(\Rightarrow\left\{{}\begin{matrix}\%m_{Fe}=\dfrac{0,1\cdot56}{11}\cdot100\%\approx50,91\%\\\%m_{Al}=49,09\%\end{matrix}\right.\)
Theo các PTHH: \(\left\{{}\begin{matrix}n_{H_2}=0,4\left(mol\right)\\n_{FeSO_4}=0,1\left(mol\right)\\n_{Al_2\left(SO_4\right)_3}=0,3\left(mol\right)\end{matrix}\right.\) \(\Rightarrow\left\{{}\begin{matrix}V_{H_2}=0,4\cdot22,4=8,96\left(l\right)\\C_{M_{FeSO_4}}=\dfrac{0,1}{0,2}=0,5\left(M\right)\\C_{M_{Al_2\left(SO_4\right)_3}}=\dfrac{0,3}{0,2}=1,5\left(M\right)\end{matrix}\right.\)
a) nH2SO4=0,4(mol)
Đặt: nFe=x(mol); nAl=y(mol) (x,y>0)
PTHH: Fe + H2SO4 -> FeSO4 + H2
x________x______x______x(mol)
2Al + 3 H2SO4 -> Al2(SO4)3 + 3 H2
y____1,5y_______0,5y_______1,5y(mol)
Ta có hpt:
\(\left\{{}\begin{matrix}56x+27y=11\\x+1,5y=0,4\end{matrix}\right.\Leftrightarrow\left\{{}\begin{matrix}x=0,1\\y=0,2\end{matrix}\right.\)
=> mFe=0,1.56=5,6(g)
=>%mFe=(5,6/11).100=50,909%
=>%mAl= 49,091%
b) V(H2,đktc)=0,4.22,4=8,96(l)
c) nAl2(SO4)3= 0,5y=0,5.0,2=0,1(mol)
nFeSO4=x=0,1(mol)
Vddsau=VddH2SO4=0,2(l)
=>CMddAl2(SO4)3= 0,1/0,2=0,5(M)
CMddFeSO4=0,1/0,2=0,5(M)

PTHH: \(Fe+2HCl\rightarrow FeCl_2+H_2\uparrow\)
a_____2a______a____a (mol)
\(Mg+2HCl\rightarrow MgCl_2+H_2\uparrow\)
b_____2b_______b____b (mol)
Ta lập hệ phương trình: \(\left\{{}\begin{matrix}56a+24b=10,4\\a+b=\dfrac{6,72}{22,4}=0,3\end{matrix}\right.\) \(\Leftrightarrow\left\{{}\begin{matrix}a=0,1\\b=0,2\end{matrix}\right.\)
\(\Rightarrow\left\{{}\begin{matrix}\%m_{Fe}=\dfrac{0,1\cdot56}{10,4}\cdot100\%\approx53,85\%\\\%m_{Mg}=46,15\%\\C_{M_{FeCl_2}}=\dfrac{0,1}{0,2}=0,5\left(M\right)\\C_{M_{MgCl_2}}=\dfrac{0,2}{0,2}=1\left(M\right)\end{matrix}\right.\)