Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

\(a,PTHH:2Al+6HCl\to 2AlCl_3+3H_2\\ \Rightarrow n_{H_2}=\dfrac{6,72}{22,4}=0,3(mol)\\ \Rightarrow n_{Al}=0,2(mol)\\ b,m_{Al}=0,2.27=5,4(g)\\ \Rightarrow m_{Cu}=11,8-5,4=6,4(g)\)

a)\(PTHH:2Al+6HCl\rightarrow2AlCl_3+3H_2\\ \Rightarrow n_{H_2}=\dfrac{6,72}{22,4}=0,3\left(mol\right)\\ \Rightarrow n_{Al}=0,2\left(mol\right)\)
b) \(m_{Al}=0,2.27=5,4\left(g\right)\\ \Rightarrow m_{Cu}=11,8-5,4=6,4\left(g\right)\)
c)Xin phép ko làm thì mik ko bt

a) \(2Al+6HCl\rightarrow2AlCl_3+3H_2\)
\(Cu+HCl\rightarrow\)(không phản ứng)
2Al + 6HCl => 2AlCl3 + 3H2
0,3/3*2 (6,72/22,4)
=> mAl = 0,2 *27 =5,4g; mCu = 11,8 - 5,4 = 6,4g

Phần 1
2Al +6 HCl ----> 2AlCl3 + 3H2 (1)
Fe + 2HCl ----> FeCl2 + H2 (2)
Cu ko pư với dd HCl
Phần 2
2Al + 2NaOH + 2H20 ---> 2NaAlO2 + 3H2 (3)
Fe và Cu ko pư với dd NaOH
Theo pt(3) n Al = \(\frac{2}{3}\).n H2=\(\frac{2}{3}\). \(\frac{3,36}{22,4}\)=0,1 (mol)
%m Al= \(\frac{0,1.27}{20}\).100%= 13,5%
Theo pt(1)(2) tổng n H2=\(\frac{3}{2}\). nAl + n Fe=\(\frac{5,6}{22,4}\)
==> 0,15 + n Fe = 0,25 ==> n Fe = 0,1 (mol)
%m Fe= \(\frac{0,1.56}{20}\).100%= 28%
%m Cu=100% - 13,5% - 28% =58,5%
tại sao % Al lại đem chia 20 vậy 0,1 mol là ở 1 phần thôi là chia 10 chứ .% Fe cũng thế vậy
==> tổng mAl + mFe trong 1 phần = 0,1.27 + 0,1.56=8,3
%Cu =100% - \(\dfrac{8,3}{10}\).100=17%


Số mol S O 2 = 1,5x + 0,03 = 0,06375→ x = 0,0225 mol
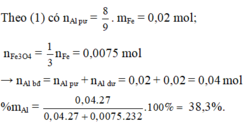
⇒ Chọn C.

Bài 1:
\(n_{H_2SO_4}=\dfrac{200.14,7\%}{98}=0,3\left(mol\right)\\ 2Al+3H_2SO_4\rightarrow Al_2\left(SO_4\right)_3+3H_2\\ n_{Al_2\left(SO_4\right)_3}=\dfrac{1}{3}.0,3=0,1\left(mol\right)\\ m_{Al_2\left(SO_4\right)_3}=342.0,1=34,2\left(g\right)\)
Bài 2:
\(n_{H_2}=\dfrac{3,36}{22,4}=0,15\left(mol\right)\\ Mg+2HCl\rightarrow MgCl_2+H_2\\ n_{Mg}=n_{H_2}=0,15\left(mol\right)\\ \Rightarrow m_{Mg}=0,15.24=3,6\left(g\right)\\ \%m_{Mg}=\dfrac{3,6}{10}.100=36\%\\ \%m_{Cu}=100\%-36\%=64\%\)

a) B là \(Al_2\left(SO_4\right)_3\), C là \(Cu\)
\(b)n_{H_2}=\dfrac{6,72}{22,4}=0,3mol\\ 2Al+3H_2SO_4\rightarrow Al_2\left(SO_4\right)_3+3H_2\)
0,2 0,3 0,1 0,3
\(m_{hh}=0,2.27+3,2=8,6g\\ \%m_{Cu}=\dfrac{3,2}{8,6}\cdot100=37,21\%\\ \%m_{Al}=100-37,21=62,79\%\\ c)C_{M_{H_2SO_4}}=\dfrac{0,3}{0,25}=1,2M\)
\(2Al+3H_2SO_4\rightarrow Al_2\left(SO_4\right)_3+3H_2\)
\(n_{Al}=\dfrac{2}{3}n_{H_2}=0,2\left(mol\right)\)
=> \(m_{Al}=0,2.27=5,4\left(g\right)\)
=> \(m_{Cu}=11,8-5,4=6,4\left(g\right)\)