Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

gọi nFe2O3=a(mol) nCuO=b(mol) Sau khi cho qua H2 dư=> nFe=2a n Cu=b
Áp dụng bảo toàn e: nSO2=(6a+2b)/2=3a+b(mol)
m tăng= 56. 2a+ 64b-(3a+b)32=7,2 (1)
m hh ban đầu= 160a + 80b= 24(2)
Từ (1) và (2) ta được a=0,05 b=0,2
=> mFe =2,8(g) mCu=12,8(g)

$a)$
Đặt $n_{Al}=x(mol);n_{Fe}=y(mol)$
$\to 27x+56y=13,75(1)$
Bảo toàn e: $1,5x+y=n_{H_2}=\dfrac{11,2}{22,4}=0,5(2)$
Từ $(1)(2)\to x=0,25(mol);y=0,125(mol)$
$\to \%m_{Al}=\dfrac{0,25.27}{13,75}.100\%\approx 49,09\%$
$\to \%m_{Fe}=100-49,09=50,91\%$
$b)$
Bảo toàn H: $n_{HCl}=2n_{H_2}=1(mol)$
$\to a=\dfrac{1.36,5.120\%}{18,25\%}=240(g)$
$c)$
Bảo toàn Al,Fe: $n_{AlCl_3}=0,25(mol);n_{FeCl_2}=0,125(mol)$
$m_{dd_{HCl(p/ứ)}}=\dfrac{1.36,5}{18,25\%}=200(g)$
Ta có $m_{dd\, sau}=13,75+200-0,5.2=212,75(g)$
$\to \begin{cases} C\%_{AlCl_3}=\dfrac{0,25.133,5}{212,75}.100\%=15,69\%\\ C\%_{FeCl_2}=\dfrac{0,125.127}{212,75}.100\%=7,46\% \end{cases}$

a)
Gọi \(\left\{{}\begin{matrix}n_{Fe}=a\left(mol\right)\\n_{Mg}=b\left(mol\right)\end{matrix}\right.\)
=> 56a + 24b = 18,4 (1)
PTHH: Fe + 2HCl --> FeCl2 + H2
a-->2a------>a------>a
Mg + 2HCl --> MgCl2 + H2
b--->2b------->b------>b
=> \(a+b=\dfrac{11,2}{22,4}=0,5\) (2)
(1)(2) => a = 0,2 (mol); b = 0,3 (mol)
\(\left\{{}\begin{matrix}\%m_{Fe}=\dfrac{0,2.56}{18,4}.100\%=60,87\%\\\%m_{Mg}=\dfrac{0,3.24}{18,4}.100\%=39,13\%\end{matrix}\right.\)
b) \(n_{HCl\left(pư\right)}=2a+2b=1\left(mol\right)\)
=> \(n_{HCl\left(tt\right)}=\dfrac{1.125}{100}=1,25\left(mol\right)\)
=> mHCl(tt) = 1,25.36,5 = 45,625 (g)
=> \(a=\dfrac{45,625.100}{18,25}=250\left(g\right)\)
c)
mdd sau pư = 18,4 + 250 - 0,5.2 = 267,4 (g)
\(C\%_{FeCl_2}=\dfrac{0,2.127}{267,4}.100\%=9,5\%\)
\(C\%_{MgCl_2}=\dfrac{0,3.95}{267,4}.100\%=10,66\%\)

Đặt \(\left\{{}\begin{matrix}n_{Mg}=a\left(mol\right)\\n_{Fe}=b\left(mol\right)\\n_{Zn}=c\left(mol\right)\\n_{Al}=d\left(mol\right)\end{matrix}\right.\) \(\Rightarrow95a+127b+136c+133,5d=40,45\) (1)
Sau p/ứ với Clo, ta được: \(95a+162,5b+136c+133,5d=44\) (2)
Lấy PT (2) trừ PT (1) \(\Rightarrow35,5b=3,55\) \(\Rightarrow b=n_{Fe}=0,1\left(mol\right)\)
\(\Rightarrow\%m_{Fe}=\dfrac{0,1\cdot56}{13,47}\cdot100\%\approx41,57\%\)

Đáp án B
Đặt
![]()
Khối lượng muối khan giảm là do đã xảy ra phản ứng thay thế các nguyên tử halogen trong muối.
Ta có hệ:
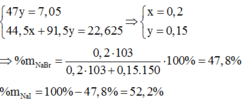

Chọn đáp án C
Gọi số mol của NaBr là x mol; NaI là y mol.
Cho B r 2 vào dung dịch A, chỉ NaI phản ứng.
NaI + 1 2 Br2 → NaBr + 1 2 I2
1 mol NaI → 1 mol NaBr khối lượng giảm 47g
→ n N a I = 7 , 05 47 = 0,15 mol = y
Khi sục khí Clo vào dung dịch A, cả NaBr và NaI phản ứng.
m m u ố i g i ả m = x.(80 – 35,5) + y (127-35,5) = 22,625 g
→ x = 0,2 mol
ð % m N a B r = 0 , 2 . 103 0 , 2 . 103 + 0 , 15 . 150 .100(%) = 47,80(%)
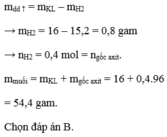
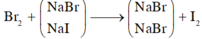
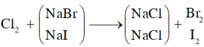
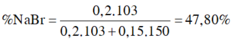
\(m_{H_2}=11,88-11,73=0,15\left(g\right)\)
=> \(n_{H_2}=\dfrac{0,15}{2}=0,075\left(mol\right)\)
PTHH: Fe + 2HCl --> FeCl2 + H2
0,075<---------------0,075
=> \(\%m_{Fe}=\dfrac{0,075.56}{11,88}.100\%=35,35\%\)
\(m_{tăng}=m_X-m_{H_2}\Rightarrow m_{H_2}=11,88-11,73=0,15mol\)
\(\Rightarrow n_{H_2}=0,075mol\)
\(Fe+2HCl\rightarrow FeCl_2+H_2\)
0,075 0,075
\(\Rightarrow m_{Fe}=0,075\cdot56=4,2g\)
\(\%m_{Fe}=\dfrac{4,2}{11,88}\cdot100\%=35,35\%\)