Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Câu 5:
Ở 90 độ C, 100g - 50g - 150g dd
450g 225g - 675g dd
Gọi số mol CuSO4.5H2O là x (mol)
\(\rightarrow m_{CuSO_4}=160x\left(g\right)\rightarrow m_{CuSO_4\left(còn\right)}=225-160x\left(g\right)\)
\(m_{H_2O}=180x\left(g\right)\rightarrow m_{H_2O\left(còn\right)}=450-180x\left(g\right)\)
Ở 10 độ C, 100 g nước thu được 36g CuSO4.
450-180x(g) 225-160x(g)
\(\rightarrow\left(450-180x\right).36=100.\left(225-160x\right)\)
\(\rightarrow16200-6480x=22500-16000x\)
\(16000x-6480x=22500-16200\)
\(\rightarrow x\approx0,662\)
\(m_{CuSO_4.5H_2O}=0,662.\left(160+180\right)=225\left(g\right)\)

a. \(n_{CH_4}=\dfrac{10.08}{22,4}=0,45\left(mol\right)\)
PTHH : CH4 + 2O2 ----to---> CO2 + 2H2O
0,45 0,9 0,45
\(V_{O_2}=0,9.22,4=20,16\left(l\right)\)
\(V_{kk}=20,16.5=100,8\left(l\right)\)
b. \(m_{CO_2}=0,45.44=19,8\left(g\right)\)
c. PTHH : 2KMnO4 -> K2MnO4 + MnO2 + O2
1,8 0,9
\(m_{KMnO_4}=1,8.158=284,4\left(g\right)\)
Bài 1:
Ta có nCH4 = 5,622,4 = 0,25 ( mol )
CH4 + 2O2 → H2O + CO2↑
0,25......0,5.......0,25....0,25
=> VO2 = 0,5 . 22,4 = 11,2 ( lít )
=> mH2O = 18 . 0,25 = 4,5 ( gam )
=> mCO2 = 0,25 . 44 = 11 ( gam )

Tính:
a) Số mol của 26g Zn
- Khối lượng mol của Zn: Zn = 65 g/mol
\(\Rightarrow n=\dfrac{m}{M}=\dfrac{26}{65}=0,4mol\)
b) Khối lượng của 0,25 mol N2O
- Khối lượng mol của N2O: \(N_2O=14.2+16=44g/mol\)
\(\Rightarrow m=n.M=0,25.44=11g\)
c) Thể tích của 3,84g khí CH4 (ở đkc)
- Khối lượng mol của CH4: \(CH_4=12+4=16g\)/mol
- Số mol: \(n=\dfrac{m}{M}=\dfrac{3,84}{16}=0,24mol\)
\(\Rightarrow V=n.24,79=0,24.24,79=5,9496l\)
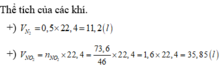
\(n_{NO_2}=\dfrac{11.5}{46}=0.25\left(mol\right)\)
\(V_{NO_2}=0.25\cdot22.4=5.6\left(l\right)\)
\(n_{NO_2}=\dfrac{11,5}{46}=0,25mol\)
\(\xrightarrow[]{}V_{NO_2}=0,25.22,4=5,6\left(l\right)\)