
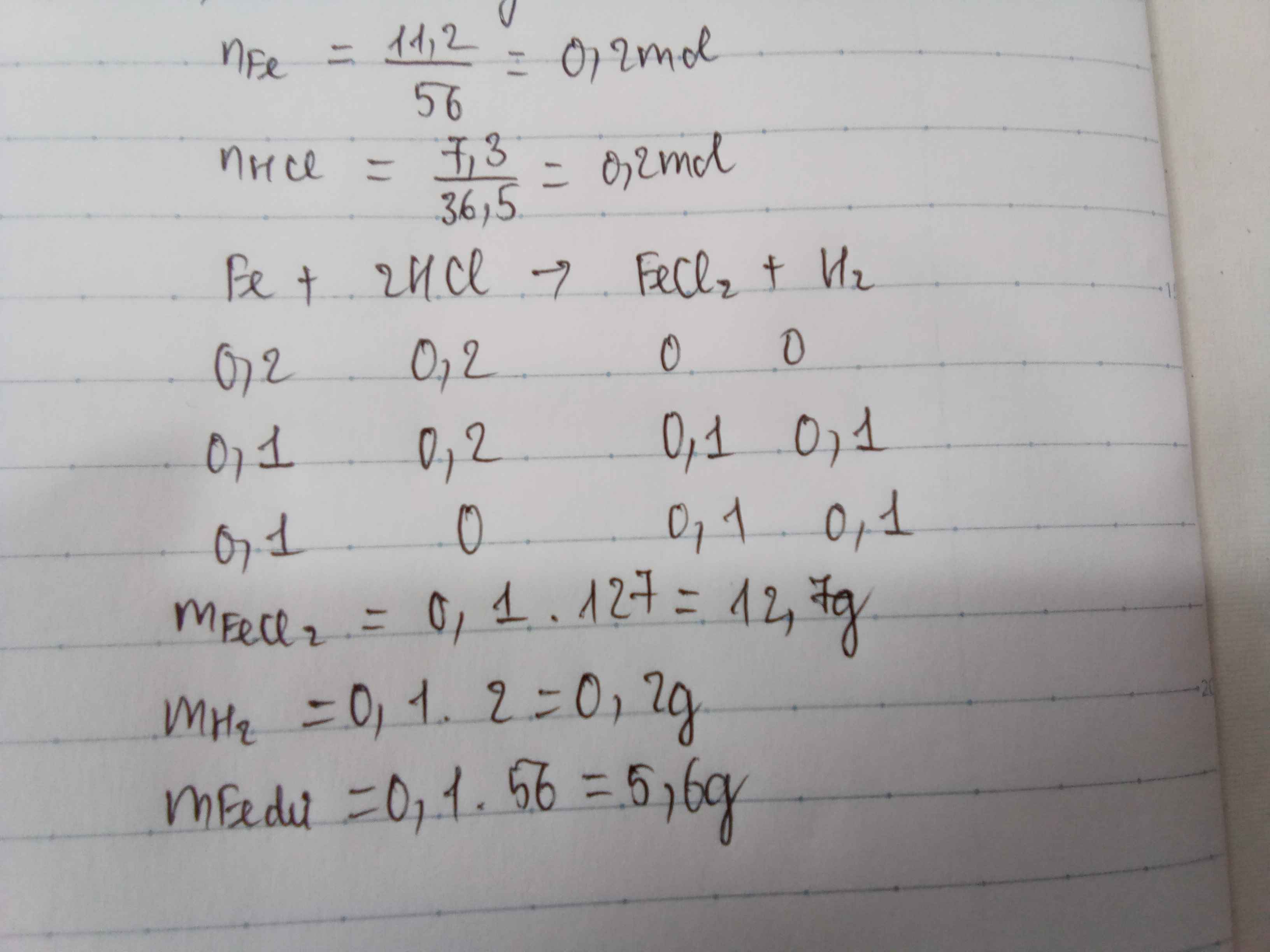
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

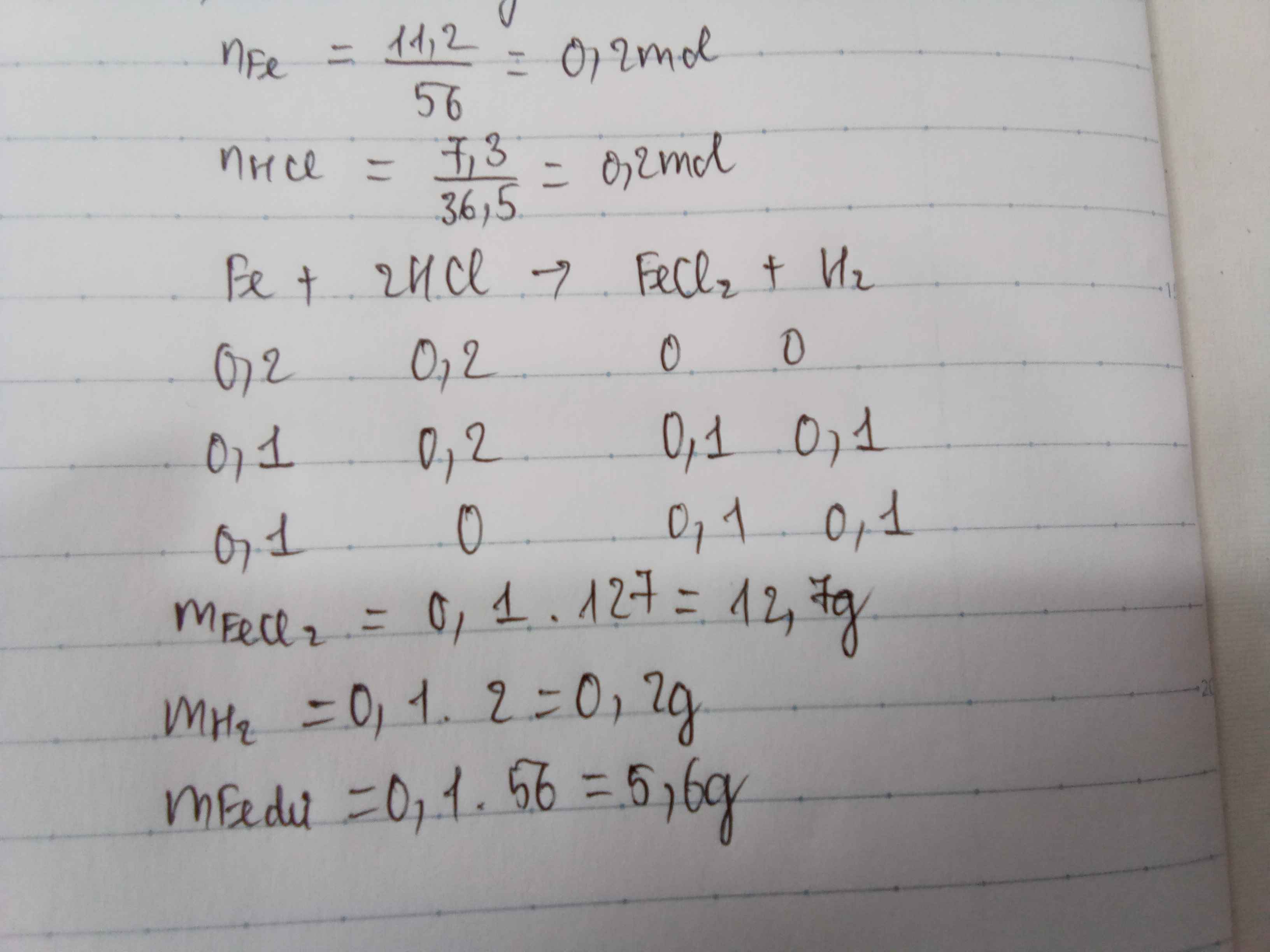

\(n_{Al}=\dfrac{5,4}{27}=0,2mol\)
\(n_{HCl}=\dfrac{7,3}{36,5}=0,2mol\)
\(2Al+6HCl\rightarrow2AlCl_3+3H_2\)
\(\dfrac{0,2}{2}\) > \(\dfrac{0,2}{6}\) ( mol )
1/15 0,2 1/15 0,1 ( mol )
\(m_{AlCl_3}=\dfrac{1}{15}.13,5=8,9g\)
\(m_{H_2}=0,1.2=0,2g\)
\(m_{Al\left(dư\right)}=\left(0,2-\dfrac{1}{15}\right).27=3,6g\)

\(a.PTHH:Zn+2HCl\rightarrow ZnCl_2+H_2\)
\(b.n_{Zn}=\dfrac{m}{M}=\dfrac{13}{65}=0,2\left(mol\right)\\ n_{HCl}=\dfrac{m}{M}=\dfrac{3,65}{\left(1+35,5\right)}=0,1\left(mol\right)\)
Tỉ lệ: \(\dfrac{0,2}{1}>\dfrac{0,1}{2}\Rightarrow Zn\) dư và dư \(m_{Zn}=n.M=0,2.65=13\left(g\right)\)
\(PTHH:Zn+2HCl\rightarrow ZnCl_2+H_2\)
1 2 1 1
0,05 0,1 0,05 0,05
\(m_{ZnCl_2}=n.M=0,05.\left(65+35,5.2\right)=6,8\left(g\right)\\ m_{H_2}=n.M=0,05.2=0,1\left(g\right).\)
a)\(PTHH:Zn+2HCl\xrightarrow[]{}ZnCl_2+H_2\)
b)\(n_{Zn}=\dfrac{13}{65}=0,2\left(m\right)\)
\(n_{HCl}=\dfrac{3,65}{36,5}=0,1\left(m\right)\)
\(PTHH:Zn+2HCl\xrightarrow[]{}ZnCl_2+H_2\)
ta có tỉ lệ:\(\dfrac{0,2}{1}>\dfrac{0,1}{2}=>Zn\) dư
\(PTHH:Zn+2HCl\xrightarrow[]{}ZnCl_2+H_2\)
tỉ lệ :1 2 1 2
số mol :0,05 0,1 0,05 0,05
\(m_{ZnCl_2}=0,05.136=6,8\left(g\right)\)
\(m_{H_2}=0,05.2=0,1\left(g\right)\)

\(n_{H_2}=\dfrac{5,6}{22,4}=0,25(mol)\\ a,PTHH:Fe+2HCl\to FeCl_2+H_2\\ 2Al+6HCl\to 2AlCl_3+3H_2\)
\(b,\) Đặt \(n_{Fe}=x(mol);n_{Al}=y(mol)\)
\(\Rightarrow 56x+27y=8,3(1)\)
Theo PTHH: \(x+1,5y=0,25(2)\)
\((1)(2)\Rightarrow x=y=0,1(mol)\\ \Rightarrow \%_{Fe}=\dfrac{0,1.56}{8,3}.100\%=67,47\%\\ \%_{Al}=100\%-67,47\%=32,53\%\)

\(n_{Fe}=\dfrac{11,2}{56}=0,2\left(mol\right)\\
n_{H_2SO_4}=\dfrac{24,5}{98}=0,25\left(mol\right)\\
pthh:Fe+H_2SO_4\rightarrow FeSO_4+H_2\uparrow\)
\(LTL:\dfrac{0,2}{1}< \dfrac{0,25}{1}\)
=> H2SO4 dư
\(n_{H_2}=n_{H_2SO_4\left(p\text{ư}\right)}=n_{Fe}=0,2\left(mol\right)\\
V_{H_2}=0,2.22,4=4,48l\\
m_{H_2SO_4\left(d\right)}=\left(0,25-0,2\right).98=4,9g\)

a) $Fe + 2HCl \to FeCl_2 + H_2$
b) Sửa đề : 6,5 $\to$ 5,6
n Fe = 5,6/56 = 0,1(mol)
n HNO3 = 0,3.2 = 0,6(mol)
Fe + 4HNO3 $\to$ Fe(NO3)3 + NO + 2H2O
Ta thấy : n Fe /1 = 0,1 < n HNO3 /4 = 0,15 nên HNO3 dư
Theo PTHH : n HNO3 pư = 4n Fe = 0,4(mol)
=> m HNO3 dư = (0,6 - 0,4).63 = 12,6 gam
c)
Kẽm tan dần, xuất hiện khí không màu hóa nâu trong không khí , dung dịch chuyển từ nâu đỏ sang không màu
$3Zn + 8HNO_3 \to 3Zn(NO_3)_2 + 2NO + 4H_2O$
$Zn + 2Fe(NO_3)_3 \to Zn(NO_3)_2 + 2Fe(NO_3)_2$

a, \(n_{H_2}=\dfrac{1,12}{22,4}=0,05\left(mol\right)\)
PTHH: Cu + H2SO4 l → ko phản ứng
PTHH: Fe + H2SO4 → FeSO4 + H2
Mol: 0,05 0,05 0,05
\(m_{Fe}=0,05.56=2,8\left(g\right)\Rightarrow m_{Cu}=3,44-2,8=0,64\left(g\right)\)
b, \(m_{H_2SO_4}=0,05.98=4,9\left(g\right)\)

a:
nFe=11,2/56=0,2(mol)
Fe+2HCl->FeCl2+H2
0,2 0,2
b: V=0,2*22,4=4,48(lít)