Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

a) Phương trình hóa học của phản ứng: Gọi X là kí hiệu nguyên tử khối của halogen.
Mg + X2 → MgX2
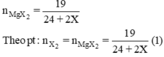
2Al + 3X2 → 2AlX3.
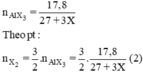
Cho (1) = (2). Giải ta rút ra X = 35,5 (Cl)
b) Thay X = 35,5 vào (1) ⇒ nCl2 = 0,2 mol ⇒ mCl2 = 14,2g.

KH nguyến tố halogen là X , đặt a là số mol ptu X2
ptpu:
Mg + X2 ----> MgX2
mol : a−−>a
2Al + 3X2 ---> 2AlX3
mol: a−−−>\(\frac{2a}{3}\)
từ pt => (24 + 2X).a =19 => a=\(\frac{19}{24+2X}\)
(27 + 3X).1,5a =17,8 => a= \(\frac{17,8.3}{\left(27+3X\right).2}\) =>X=35,5
![]()

a) Phương trình hóa học của phản ứng: Gọi X là kí hiệu nguyên tử khối của halogen.
2Al + 3X2 \(\rightarrow\) 2AlX3.
nAlX3 = 17,8/(27+3X).
nX2 = 3.17,8/ 2(27+3X). (1)
Mg + X2 \(\rightarrow\)MgX2
nMgX2 = 19 /(24 + 2X).
nX2 = 19/ (24+ 2X) (2).
Cho (1) = (2). Giải ta rút ra X = 35,5 (Cl)
b) mCl2 = 14,2g.
a) Phương trình hóa học của phản ứng: Gọi X là kí hiệu nguyên tử khối của halogen.
2Al + 3X2 →→ 2AlX3.
nAlX3 = 17,8/(27+3X).
nX2 = 3.17,8/ 2(27+3X). (1)
Mg + X2 →→MgX2
nMgX2 = 19 /(24 + 2X).
nX2 = 19/ (24+ 2X) (2).
Cho (1) = (2). Giải ta rút ra X = 35,5 (Cl)
b) mCl2 = 14,2g.

Mg+X2---->MgX2
n Mg=12/24=0,5(mol)
n MgX2=\(\frac{47,5}{24+2X}\left(mol\right)\)
Theo pthh
n Mg=n MgX2
-->\(\frac{47,5}{24+2X}=0,5\Leftrightarrow47,5=12+X\)
-->X=35,5(Cl)
Vậy .......

\(Mg+2HCl\rightarrow MgCl_2+H_2\)
x______2x_______x_____ x
\(Fe+2HCl\rightarrow FeCl_2+H_2\)
y____2y______y_________ y
\(\left\{{}\begin{matrix}24x+56y=8\\x+y=\frac{2,28}{22,4}=0,2\end{matrix}\right.\rightarrow x=y=0,1\)
\(\%m_{Mg}=\frac{0,1.24}{8}.100\%=30\%,\%m_{Fe}=100\%-30\%=70\%\)
\(n_{HC}=2.0,1+2.0,1=0,4\left(mol\right)\)
\(m_{dd_{HCl}}=\frac{0,4.36,5}{14,6\%}=100\left(g\right)\)
\(C\%_{MgCl2}=\frac{0,1.\left(24+71\right)}{8+100-0,1.2}.100\%=8,83\%\)
\(C\%_{FeCl_2}=\frac{0,1.\left(56+71\right)}{8+100-0,2.2}.100\%=11,8\%\)
\(Mg+X_2\rightarrow MgX_2\)
\(n_{Mg}=\frac{1,2}{24}=0,05\left(mol\right)\)
\(n_{MgX2}=\frac{4,75}{24+2X}\)
Ta có nMg=nMgX2
\(\Leftrightarrow0,05=\frac{4,75}{24+2X}\)
\(\rightarrow X=35,5\left(Cl\right)\)

Bảo toàn khối lượng ta có: $m_{R}=2,4(g)$$R+X_2\rightarrow RX_2$
Ta có: $\frac{2,4}{R}=\frac{4,26}{2X}$
Lập bảng biện luận thông qua halogen tìm được X và R lần lượt là Cl và Ca

Gọi tên của đơn chất halogen là X
\(Fe+3X\underrightarrow{t^o}FeX_3\)
ta có :\(\dfrac{56}{11,2}=\dfrac{56+3X}{32,5}\) => X = 35,5
Vậy X là Clo ( Cl )
nFe = 0,2 mol
Fe + 3M → FeM3
0,2..................0,2
⇒ \(\dfrac{32,5}{56+3M}\) = 0,2
⇔ 32,5 = 11,2 + 0,6M
⇔ 21,3 = 0,6M
⇔ M = 35,5 (Cl)
Vậy M là clo