Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

a) Phương trình hóa học của phản ứng:
b) Theo pt (1): nCl2 = nMnCl2 = nMnO2 = 0,8 mol
Theo pt (2): nNaCl = nNaClO = nCl2 = 0,8 mol
nNaOH pư = 2. nCl2 = 2. 0,8 = 1,6 mol
⇒ nNaOH dư = 2 - 1,6 = 0,4 mol
Nồng độ mol/l của các chất trong dung dịch sau phản ứng:
CM (NaCl) = CM (NaClO) = CM(MnCl2) = 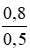
CM (NaOH)dư = 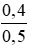
tích cho mình nha![]()

\(300(ml)=0,3(l)\\ n_{HCl}=1.0,3=0,3(mol);n_{Fe}=\dfrac{5,6}{56}=0,1(mol)\\ a,PTHH:Fe+2HCl\to FeCl_2+H_2\\ \text{LTL: }\dfrac{n_{Fe}}{1}<\dfrac{n_{HCl}}{2}\Rightarrow HCl\text{ dư}\\ \Rightarrow n_{HCl(dư)}=0,3-0,1.2=0,1(mol)\\ \Rightarrow m_{HCl(dư)}=0,1.36,5=3,65(g)\\ b,n_{FeCl_2}=n_{Fe}=0,1(mol)\\ \Rightarrow \begin{cases} C_{M_{FeCl_2}}=\dfrac{0,1}{0,3}=0,33M\\ C_{M_{HCl(dư)}}=\dfrac{0,1}{0,3}=0,33M \end{cases}\)

a)\(Fe+2HCl\rightarrow FeCl_2+H_2\)
\(n_{Fe}=\dfrac{5,6}{56}=0,1\left(mol\right)\)
\(n_{HCL}=0,1.1=0,1\left(mol\right)\)
\(\Rightarrow n_{H_2}=2nH_2=2,0,1=0,2\left(mol\right)\)
\(\Rightarrow V_{H_2}=0,2.22,4=4,48\left(ml\right)\)
b) sau pư Fe dư
ta có 1 molFe Pư 2 molHCL
0,05 molFe pư 0,1 HCL
\(\Rightarrow n_{Fe\left(dư\right)}:0,1-0,05=0,05\left(mol\right)\)
c)\(C_{MFeCL_2}=\dfrac{2.n_{HCL}}{0,1}=2M\)

nCaCO3=8,4:(40+12+16.3)=0,084 mol
nH2SO4= 0,5.1=0,5 mol
PTHH: H2SO4+ CaCO3 --> CaSO4↓ + CO2 +H2O
theo đề: 0,5 mol: 0,084 mol
=> H2SO4 de theo CaCO3
phản ứng : 0,084mol<----0,084 mol---> 0,084mol
=> CM=\(\frac{0,084}{0,5}=0,168M\)

Ta có: nFe=5,656=0,1(mol)
nHCl=0,1.1=0,1(mol)
PT: Fe+2HCl→FeCl2+H2
Xét tỉ lệ: 0,11>0,12, ta được Fe dư.
a, Theo PT: nH2=12nHCl=0,05(mol)
⇒ VH2 = 0,05.22,4 = 1,12 (l)
PTHH: \(Fe+2HCl\rightarrow FeCl_2+H_2\uparrow\)
Ta có: \(\left\{{}\begin{matrix}n_{Fe}=\dfrac{5,6}{56}=0,1\left(mol\right)\\n_{HCl}=0,1\cdot1=0,1\left(mol\right)\end{matrix}\right.\)
Xét tỉ lệ: \(\dfrac{0,1}{1}>\dfrac{0,1}{2}\) \(\Rightarrow\) Sắt còn dư, HCl p/ứ hết
\(\Rightarrow n_{Fe\left(dư\right)}=0,05\left(mol\right)=n_{FeCl_2}\) \(\Rightarrow\left\{{}\begin{matrix}m_{Fe\left(dư\right)}=0,05\cdot56=2,8\left(g\right)\\C_{M_{FeCl_2}}=\dfrac{0,05}{0,1}=0,5\left(M\right)\end{matrix}\right.\)

Ta có: \(n_{MgO}=\dfrac{4}{40}=0,1\left(mol\right)\)
\(n_{HCl}=4.100:1000=0,4\left(mol\right)\)
a. PTHH: MgO + 2HCl ---> MgCl2 + H2O
Ta thấy: \(\dfrac{0,1}{1}< \dfrac{0,4}{2}\)
Vậy HCl dư.
=> \(n_{dư}=\dfrac{0,1.2}{0,4}=0,5\left(mol\right)\)
=> \(m_{dư}=0,5.36,5=18,2\left(g\right)\)
b. Ta có: \(V_{dd_{MgCl_2}}=V_{HCl}=\dfrac{100}{1000}=0,1\left(lít\right)\)
Theo PT: \(n_{MgCl_2}=n_{MgO}=0,1\left(mol\right)\)
=> \(C_{M_{MgCl_2}}=\dfrac{0,1}{0,1}=1M\)

– Số mol KMnO4 = 0,2 (mol); số mol KOH = 2 (mol)
– Phương trình phản ứng:
2KMnO4 + 16HCl → 2KCl + 2MnCl2 + 5Cl2 + 8H2O
0,2 0,5
* Ở điều kiện nhiệt độ thường:
Cl2 + 2KOH → KCl + KClO + H2O
0,5 1,0 0,5 0,5
– Dư 1,0 mol KOH
CM (KCl) = CM (KClO) = 0,5 (M); CM (KOH dư) = 1 (M)
* Ở điều kiện đun nóng trên 700C:
3Cl2 + 6KOH → 5KCl + KClO3 + 3H2O
0,5 1,0 5/6 1/6
– Dư 1,0 mol KOH
CM (KCl) = 5/6 (M); CM (KClO3) = 1/6 (M); CM (KOH dư) = 1 (M).
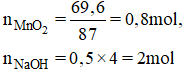
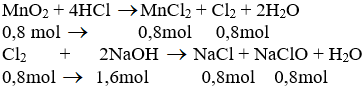
$n_{CaO} = \dfrac{11,2}{56} = 0,2(mol)$
$n_{HCl} = 0,5.1 = 0,5(mol)$
$CaO + dư2HCl \to CaCl_2 + H_2O$
Ta thấy :
$n_{CaO} : 1 < n_{HCl} : 2$ nên $HCl$ dư
$n_{HCl\ pư} = 2n_{CaO} = 0,4(mol)$
$m_{HCl\ dư} = (0,5 - 0,4).36,5 = 3,65(gam)$
$n_{CaCl_2} = n_{CaO} = 0,2(mol)$
$C_{M_{HCl\ dư}} = \dfrac{0,1}{0,5} = 0,2M$
$C_{M_{CaCl_2}} = \dfrac{0,2}{0,5} = 0,4M$
\(n_{CaO}=\dfrac{11,2}{56}=0,2\left(mol\right)\\ n_{HCl}=0,5.1=0,5\left(mol\right)\\ CaO+2HCl\xrightarrow[]{}CaCl_2+H_2O\\ \Rightarrow\dfrac{0,2}{1}< \dfrac{0,5}{2}\Rightarrow HCl.dư\\ n_{HCl\left(pư\right)}=0,2.2=0,4\left(mol\right)\\ n_{HCl\left(dư\right)}=0,5-0,4=0,1\left(mol\right)\\ m_{HCl\left(dư\right)}=0,1.36,5=3,65\left(g\right)\\ n_{CaCl_2}=n_{CaO}=0,2mol\\ C_{M_{CaCl_2}}=\dfrac{0,2}{0,5}=0,4\left(M\right)\\ C_{M_{HCl}}=\dfrac{0,1}{0,5}=0,2\left(M\right)\)