Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

\(n_{X_2}=\dfrac{1,12}{22,4}=0,05\left(mol\right)\)
PTHH: \(Cu+X_2->CuX_2\)
Theo PT ta có: \(n_{CuX_2}=n_{X_2}=0,05\left(mol\right)\)
=> \(M_{CuX_2}=\dfrac{11,2}{0,05}=224\left(g/mol\right)\)
=> Ta có: \(64+2.X=224\)
\(\Leftrightarrow2X=160\Leftrightarrow X=80\left(Br\right)\)
Vậy nguyên tố halogen đó là Brom (Br)
X2 + Cu → CuX2
\(n_{X_2}=\dfrac{1,12}{22,4}=0,05\left(mol\right)\)
Theo PT: \(n_{CuX_2}=n_{X_2}=0,05\left(mol\right)\)
\(\Rightarrow M_{CuX_2}=\dfrac{11,2}{0,05}=224\left(g\right)\)
\(\Leftrightarrow64+2M_X=224\)
\(\Leftrightarrow2M_X=160\)
\(\Leftrightarrow M_X=80\left(g\right)\)
Vậy X là nguyên tố Brom

\(X_2+Mg\rightarrow MgX_2\)
0,1__________0,1
\(n_{X2}=\frac{2,24}{22,4}=0,1\left(mol\right)\)
\(M_{MgX2}=\frac{9,5}{0,1}=95\)
\(\Rightarrow X=35,5\left(Cl\right)\)

1/
gọi kim loại cần tìm là A
ta có: nH2= \(\dfrac{2,24}{22,4}\)= 0,1( mol)
PTPU
2A+ 2HCl\(\rightarrow\) 2ACl+ H2\(\uparrow\)
0,2.............................0,1... mol
\(\Rightarrow\) MA. 0,2= 7,8
\(\Rightarrow\) MA= \(\dfrac{7,8}{0,2}\)= 39( g/mol)
vậy kim loại cần tìm là kali( K)
mk chắc v
2/
gọi kim loại cần tìm là R
ta có: nH2= \(\dfrac{3,36}{22,4}\)= 0,15( mol)
PTPU
2R+ 2H2O\(\rightarrow\) 2ROH+ H2\(\uparrow\)
0,3...............................0,15.. mol
\(\Rightarrow\) 0,3.MR= 6,9
\(\Rightarrow\) MR= \(\dfrac{6,9}{0,3}\)= 23( g/mol)
vậy kim loại cần tìm là natri( Na)

- Gọi công thức của muối barihalogennua là BaR2 .
PTHH : \(BaR_2+H_2SO_4\rightarrow BaSO_4+2HR\)
- Gỉa sử số mol vừa đủ H2SO4 là 1 mol .
- Theo PTHH : \(n_{BaR_2}=n_{H_2SO_4}=n_{BaSO_4}=1\left(mol\right)\)
- Theo PTHH : \(n_{HR}=2n_{H_2SO_4}=2\left(mol\right)\)
\(m_{H_2SO_4}=n.M=1.98=98\left(g\right)\)
\(m_{ddH_2SO_4}=\frac{m_{H_2SO_4}.100\%}{C\%_{H_2SO_4}}=\frac{98.100\%}{5\%}=1960\left(g\right)\)
\(m_{BaR_2}=n.M=1.\left(137+2M_R\right)=137+2M_R\left(g\right)\)
\(m_{BaSO_4}=n.M=1.\left(137+32+16.4\right)=233\left(g\right)\)
- Ta có : \(m_{dd}=m_{H_2SO_4}+m_{BaR_2}-m_{BaSO_4}\)
=> \(m_{dd}=137+2M_R-233+1960=1864+2M_R\)
\(m_{HR}=n.M=2.M_{HR}=2.\left(M_R+1\right)\left(g\right)\)
Mà \(C\%_{HR}=\frac{m_{HR}}{m_{dd}}.100\%=3,77\%\)
=> \(\frac{2M_R+2}{1864-2M_R}=\frac{3,77}{100}\)
=> \(M_R\approx35,5\) ( đvc )
Vậy tên của halogen là clo .

nCu= x mol; nAg= y mol
Cu + 2H2SO4→ CuSO4 + SO2↑ + H2O (1)
2Ag + 2H2SO4→ Ag2SO4 + SO2↑ + 2H2O (2)
SO2(k) + Br2 + 2H2O → H2SO4 + 2HBr (3)
BaCl2 + H2SO4 → BaSO4↓ + 2HCl (4)
Theo PTPU (4), ta có: n↓= nBaSO4= nH2SO4 (4)= 0,08 mol
Theo PTPU (3), ta có: nSO2= nH2SO4 (4)= 0,08 mol
Theo PTPU (1) và (2), ta có: nSO2= nCu + 2nAg = x + 0,5y = 0,08 mol (5)
Tổng khối lượng hỗn hợp ban đầu: mhỗn hợp= mCu + mAg = 64x + 108y = 11,2 (6)
Giải hệ hai phương trình (5) và (6) ta được: x= 0,04 ; y= 0,08
→mCu= 0,04x64= 2,56 (g) →%mCu=2,56/11,2x100% = 22,86%
→%mAg= 100% - %mCu= 77,14%
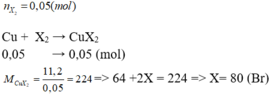
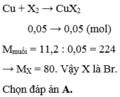
Theo đề, ta có: \(n_{X_2}=\dfrac{1,12}{22,4}=0,05\left(mol\right)\)
PTTH: \(X_2+Cu\rightarrow CuX_2\)
Số mol: 0,05 ----------> 0,05
Theo phương trình, có: \(n_{CuX_2}=n_{Cu}=0,05\left(mol\right)\)
Hay: \(\dfrac{11,2}{64+X.2}=0,05\Leftrightarrow X=80\)
Vậy X là Brom.
Chon (B)