Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

A + H2SO4 → Hỗn hợp khí ⇒ Fe dư; khí Y gồm: H2 ( x mol) và H2S (y mol)
⇒ x + y = 0,1 mol (1)
Bảo toàn S: nH2S = nFeS = nS = y mol
nFe dư = nH2 = x
Bảo toàn Fe: nFe = nFeS + nFe dư = x + y
mX = 56(x + y ) + 32y = 7,2g (2)
Từ (1)(2) ⇒ x = 0,05 mol; y = 0,05 mol
MY = mY : nY = (0,05.2 + 0,05.34) : 0,1 = 18 ⇒ dY/H2 = 9
Gọi \(\left\{{}\begin{matrix}n_{Fe}=a\left(mol\right)\\n_{FeS}=b\left(mol\right)\end{matrix}\right.\left(đk:a,b>0\right)\)
TH1: S dư
Vậy toàn bộ lượng khí sinh ra là H2S
\(d_{Y\text{/}H_2}=d_{H_2S\text{/}H_2}=\dfrac{34}{2}=17\)
TH2: Fe dư
\(n_{khí}=\dfrac{2,24}{22,4}=0,1\left(mol\right)\)
Bảo toàn KL: \(m_A=m_X=7,2\left(g\right)\)
PTHH:
\(Fe+2HCl\rightarrow FeCl_2+H_2\uparrow\)
a----------------------------->a
\(FeS+2HCl\rightarrow FeCl_2+H_2S\uparrow\)
b-------------------------------->b
Ta có hệ phương trình: \(\left\{{}\begin{matrix}56a+88b=7,2\\a+b=0,1\end{matrix}\right.\)
\(\Leftrightarrow a=b=0,05\left(TM\right)\)
\(M_Y=\dfrac{0,05.\left(2+34\right)}{0,1}=18\left(g\text{/}mol\right)\\ \rightarrow d_{Y\text{/}H_2}=\dfrac{18}{2}=9\)

\(n_k=0,6mol\)
\(d_k=d_{H_2}=26\Rightarrow d_k=52\)
Áp dụng sơ đồ đường chéo tính được là: \(n_{SO_2}=0,2mol;n_{NO_2}=0,4mol\)
Bảo toàn e: \(5^{+6}+2e\rightarrow S^{+4}\)
mol: \(0,4\rightarrow0,2\)
\(N^{+5}+1e\rightarrow N^{+4}\)
mol: \(0,4\rightarrow0,4\)
\(m_{\text{muối}}=m_{kl}+m_{SO_4^{2^-}}+m_{NO_3^-}=55,8g\)

PTHH: \(2Al+3S\underrightarrow{^{t^o}}Al_2S_3\)
Gọi số mol Al là x; S là y.
Ta có phương trình : \(27x+32y=10,2\left(g\right)\)
Vì cho Y tác dụng với HCl thu được hỗn hợp khí nên Al dư
\(\Rightarrow n_{Al_2S_3}=\dfrac{1}{3}n_S=\dfrac{y}{3}\left(mol\right)\)
\(\Rightarrow n_{Al\left(dư\right)}=x-\dfrac{2y}{3}\left(mol\right)\)
PTHH:
\(Al_2S_3+6HCl\rightarrow2AlCl_3+3H_2S\)
\(2Al+6HCl\rightarrow2AlCl_3+3H_2\)
\(\Rightarrow n_{H2S}=3n_{Al2S3}=y\left(mol\right);n_{H2}=\dfrac{3}{2}n_{Al}=1,5x-y\left(mol\right)\)
\(M_Z=18\)
Áp dụng quy tắc đường chéo :
H2S(34) H2(2) 16 16 Z(18)
\(\Rightarrow\dfrac{n_{H2S}}{n_{H2}}=\dfrac{16}{16}\Rightarrow1,5x-y=y\)
\(\Rightarrow\left\{{}\begin{matrix}x=0,2\\y=0,15\end{matrix}\right.\)
\(\Rightarrow m_{Al}=0,2.27=5,4\left(g\right)\)
\(\Rightarrow\left\{{}\begin{matrix}\%m_{Al}=\dfrac{5,4}{10,2}=52,94\%\\\%m_S=100\%-52,94\%=47,06\%\end{matrix}\right.\)

Chọn đáp án C
Gọi số mol của NaBr là x mol; NaI là y mol.
Cho B r 2 vào dung dịch A, chỉ NaI phản ứng.
NaI + 1 2 Br2 → NaBr + 1 2 I2
1 mol NaI → 1 mol NaBr khối lượng giảm 47g
→ n N a I = 7 , 05 47 = 0,15 mol = y
Khi sục khí Clo vào dung dịch A, cả NaBr và NaI phản ứng.
m m u ố i g i ả m = x.(80 – 35,5) + y (127-35,5) = 22,625 g
→ x = 0,2 mol
ð % m N a B r = 0 , 2 . 103 0 , 2 . 103 + 0 , 15 . 150 .100(%) = 47,80(%)

Đáp án B
Đặt
![]()
Khối lượng muối khan giảm là do đã xảy ra phản ứng thay thế các nguyên tử halogen trong muối.
Ta có hệ:
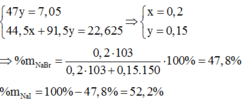
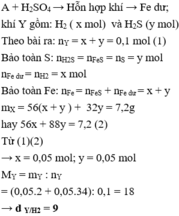

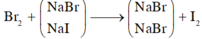
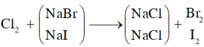
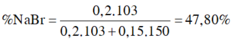
Ankin có dạng CnH2n−2
\(C_nH_{2n-2}+2H_2\underrightarrow{^{Ni,to}}C_nH_{2n+2}\)
Sau khi phản ứng hoàn toàn
\(\Rightarrow M_A=M_{CH4}=16< M_{C2H2}\) (ankin bé nhất)
Do vậy A chứa H2 dư và hidrocacbon no.
Cho nên dẫn A vào brom thì không xảy ra phản ứng \
\(n_T=0,5\left(mol\right)\Rightarrow m_T=0,5\cdot16\cdot0,6=4,8\left(g\right)=m_S\\ \Rightarrow n_S=\frac{4,8}{16}=0,3\left(mol\right)\\ n_{H_2}=n_{hh\text{ giảm }}=0,2\left(mol\right)\\ n_{C_nH_{2n-2}}=0,3\left(mol\right)\\ C_nH_{2n-2}+H_2\rightarrow C_nH_{2n}\)
0,2_________0,2
\(\Rightarrow m_{\text{bình tăng }}=4,8\left(g\right)\)