Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

đây ạ
nFe = 8.4/56=0.15 mol
nCu = 6.4/64=0.1 mol
nAgNO3 = 0.35*2=0.7 mol
Fe + 2AgNO3 --> Fe(NO3)2 + 2Ag
0.15___0.3________0.15_____0.3
Cu + 2AgNO3 --> Cu(NO3)2 + 2Ag
0.1____0.2________0.1_______0.2
nAgNO3( còn lại ) = 0.7 - 0.3 - 0.2 = 0.2 mol
Vì : AgNO3 còn dư nên tiếp tục phản ứng với Fe(NO3)2
Fe(NO3)2 + AgNO3 --> Fe(NO3)3 + Ag
Bđ: 0.15________0.2
Pư: 0.15________0.15_______________0.15
Kt: 0___________0.05_______________0.15
Chất rắn : 0.65 (mol) Ag
mAg = 0.65*108 = 70.2g

Sau phản ứng còn 2,8g Fe nên dd Y chỉ chứa FeCl2
nHCl=0,8 mol
![]()
![]()
![]()
![]()
![]()
![]()
![]()
Đáp án B

Ta có: \(n_{Mg}=\dfrac{21,6}{24}=0,9\left(mol\right)\)
\(n_{N_2O}=\dfrac{3,36}{22,4}=0,15\left(mol\right)\)
BT e, có: 2nMg = 8nN2O + 8nNH4+
⇒ nNH4+ = 0,075 (mol)
BTNT Mg: nMg(NO3)2 = nMg = 0,9 (mol)
⇒ m = mMg(NO3)2 + mNH4NO3 = 0,9.148 + 0,075.80 = 139,2 (g)
Ta có: nHNO3 = 10nN2O + 10nNH4+ = 0,15.10 + 0,075.10 = 2,25 (mol)
\(\Rightarrow V_{HNO_3}=\dfrac{2,25}{1}=2,25\left(l\right)\)

Ta có: \(n_{N_2O}+n_{NO_2}+n_{N_2}=\dfrac{11,2}{22,4}=0,5\left(mol\right)\left(1\right)\)
\(n_{HNO_3}=1,85.2=3,7\left(mol\right)\)
⇒ 10nN2O + 2nNO2 + 12nN2 = 3,7 (2)
\(n_{Mg}=\dfrac{16,8}{24}=0,7\left(mol\right)\)
\(n_{Fe}=\dfrac{28}{56}=0,5\left(mol\right)\)
BT e, có: 8nN2O + nNO2 + 10nN2 = 2nMg + 3nFe = 2,9 (3)
Từ (1), (2) và (3) \(\Rightarrow\left\{{}\begin{matrix}n_{N_2O}=0,15\left(mol\right)\\n_{NO_2}=0,2\left(mol\right)\\n_{N_2}=0,15\left(mol\right)\end{matrix}\right.\)
\(\Rightarrow\%V_{N_2}=\dfrac{0,15}{0,5}.100\%=30\%\)
m muối = mMg + mFe + 62.(8nN2O + nNO2 + 10nN2) = 224,6 (g)
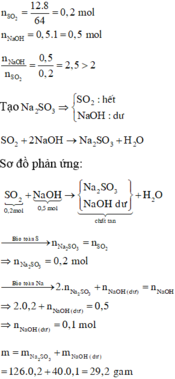




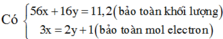
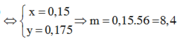
Sửa đề: Fe(NO3)2 → Fe(NO3)3
\(n_{Fe}=\dfrac{11,2}{56}=0,2\left(mol\right)\)
\(n_{Fe\left(NO_3\right)_3}=0,4.0,8=0,32\left(mol\right)\)
PT: \(Fe+2Fe\left(NO_3\right)_3\rightarrow3Fe\left(NO_3\right)_2\)
Xét tỉ lệ: \(\dfrac{0,2}{1}>\dfrac{0,32}{2}\), ta được Fe dư.
Theo PT: \(n_{Fe\left(NO_3\right)_2}=\dfrac{3}{2}n_{Fe\left(NO_3\right)_3}=0,48\left(mol\right)\)
\(\Rightarrow m_{Fe\left(NO_3\right)_2}=0,48.180=86,4\left(g\right)\)