Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

a,
Fe + 2HCl ---> FeCl2 + H2 (1)
mol: x----------------------------x
2Al + 6HCl ---> 2AlCl3 + 3H2 (2)
mol: y------------------------------\(\dfrac{3}{2}\)y
nH2= \(\dfrac{6,72}{22,4}\) = 0,3 mol
Ta có hệ phương trình: \(\left\{{}\begin{matrix}56x+27y=11,1\\x+\dfrac{3}{2}y=0,3\end{matrix}\right.\) <=> \(\left\{{}\begin{matrix}x=0,15\\y=0,1\end{matrix}\right.\)
=> %mFe= \(\dfrac{0,15.56}{11,1}.100\%\) = 76%
=> %mAl= 24%
Gọi CTHH Oxit của M là M2Ox
PTPỨ:
M2Ox + xH2 => 2M + xH2O
nH2 = 0,3 (mol)
Theo PTPỨ: nM2Ox = \(\dfrac{1}{x}\)nH2 = \(\dfrac{0,3}{x}\) (mol)
=> MM2Ox = 58x
=> M = 21x
Ta có bảng biện luận
| x | 1 | 2 | 3 | \(\dfrac{8}{3}\) |
| M | 21 | 42 | 63 | 56 |
| (loại) | (loại) | (loại) | (Fe) |
=> M là Fe (Sắt)
CTHH oxit của M là Fe3O4

Gọi a, b lần lượt là mol của Al và Zn
\(2Al+6HCl\rightarrow2AlCl_3+3H_2\)
a 1,5a
\(Zn+2HCl\rightarrow ZnCl_2+H_2\)
b b
\(\Rightarrow\left\{{}\begin{matrix}27a+65b=9,2\\1,5a+b=\dfrac{5,6}{22,4}\end{matrix}\right.\) \(\Leftrightarrow\left\{{}\begin{matrix}a=0,1\\b=0,1\end{matrix}\right.\)
\(\%m_{Al}=\dfrac{0,1.27}{9,2}.100\%=29,35\%\)
\(\%m_{Zn}=\dfrac{0,1.65}{9,2}.100\%=70,35\%\)
b. \(n_{H_2}=0,25mol\) \(\Rightarrow n_{HCl}=0,5mol\)
\(\Rightarrow m_{HCl}=0,5.36,5=18,25g\)
Ta có: \(10\%=\dfrac{18,25}{m_{dd}}.100\%\)
\(\Leftrightarrow m_{dd}=182,5g\)

a) Đặt số mol của MO, M(OH)2, MCO3 tương ứng là x, y, z.
Nếu tạo muối trung hòa ta có các phản ứng:
MO + H2SO4 →MSO4 + H2O (1)
M(OH)2 + H2SO4 →MSO4 + 2H2O (2)
MCO3 + H2SO4 →MSO4 + H2O + CO2 (3)
Nếu tạo muối axít ta có các phản ứng:
MO + 2H2SO4 →M(HSO4)2 + H2O (4)
M(OH)2 + 2H2SO4 →M(HSO4)2 + 2H2O (5)
MCO3 + 2H2SO4 →M(HSO4)2 + H2O + CO2 (6)
Ta có :
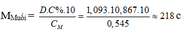
– TH1: Nếu muối là MSO4 M + 96 = 218 M = 122 (loại)
– TH2: Nếu là muối M(HSO4)2 M + 97.2 = 218 M = 24 (Mg)
Vậy xảy ra phản ứng (4, 5, 6) tạo muối Mg(HSO4)2
b) Theo (4, 5, 6) Số mol CO2 = 0,448/22,4 = 0,02 molz = 0,02 (I)
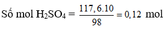
2x + 2y + 2z = 0,12 (II)
Đề bài: 40x + 58y + 84z = 3,64 (III)
Giải hệ (I, II, III): x = 0,02; y = 0,02; z = 0,02
%MgO = 40.0,02.100/3,64 = 21,98%
%Mg(OH)2 = 58.0,02.100/3,64 = 31,87%
%MgCO3 = 84.0,02.100/3,64 = 46,15%

a,
Số mol của H2 là :
nH2 = \(\dfrac{V}{22,4}\)= \(\dfrac{6,72}{22,4}\)= 0,3 ( mol )
PTHH
2Al + 6HCl \(\rightarrow\) 2AlCl3 + 3H2 \(\uparrow\) (1)
2 mol 6 mol 3 mol
0,2 mol 0,6 mol 0,3 mol
Khối lượng của Al trong hỗn hợp là
mAl= n.M = 0,2 . 27 = 5,4 ( g )
Khối lượng của MgO trong hỗn hợp là :
mMgO9= 9,4 - 5,4 = 4 ( g)
Thành phần % theo khối lượng của Al và MgO trong hỗn hợp là :
%Al = \(\dfrac{5,4}{9,4}\). 100 \(\approx\) 57,45 %
%MgO = \(\dfrac{4}{9,4}\). 100 \(\approx\) 42,55 %
b, Số mol của MgO là
nMgO= \(\dfrac{m}{M}\)= \(\dfrac{4}{40}\)= 0,1 (mol)
PTHH
MgO + 2HCl \(\rightarrow\) MgCl2 + H2O (2)
1mol 2 mol
0,1 mol 0,2 mol
Từ phương trình (1) và (2) suy ra số mol của HCl là
nHCl= 0,6 + 0,2 = 0,8 ( mol)
Thể tích HCl đã dùng là :
VHCl= \(\dfrac{n}{C_M}\) =\(\dfrac{0,8}{1,6}\) = 0,5 (l)




a) 2Al +6HCl --> 2AlCl3 +3H2 (1)
0,1 0,15
Fe +2HCl --> FeCl2 +H2(2)
0,15 0,15
giả sử nAl=x(mol)
nFe=y(mol)
=> 27x +56y =11,1 (I)
lại có : 1,5x +y=6,72/22,4=0,3 (II)
từ (I,II)
=>\(\left\{{}\begin{matrix}x=0,1\left(mol\right)\\y=0,15\left(môl\right)\end{matrix}\right.\)
=> %mAl=24,324(%)
%mFe=75,676(%)
b) giả sử CTTQ của oxit kim loại M là MxOy
MxOy +yH2 -to-> xM +yH2O (3)
0,3/y 0,3
nMxOy=17,4/xMM+16y(mol)
=>\(\dfrac{17,4}{xMM+16y}=\dfrac{0,3}{y}=>\)MM=21. 2y/x
xét :
=> 2y/x :8/3=> MM=56(g/mol)
=> MxOy :FexOy
FexOy +yH2 -to-> xFe +yH2O (4)
theo (4) : nH2O=nH2=0,3(mol)
ADĐLBTKL ta có :
mFe=17,4+0,3.2-0,3.18=12,6(g)
nFe=0,225(mol)
theo (4) : nFe=x/ynH2O
=> 0,225=x/y.0,3
=>x/y: 3/4
=> CTHH :Fe3O4