Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Đáp án D
Đặt công thức của hai muối là RCO3: x mol
RCO3+ 2HCl → RCl2+ CO2+ H2O
x 2x x x mol
Theo định luật bảo toàn khối lượng:
mmuối cacbonat+ mHCl= m muối clorua+ mCO2+ mH2O
→ 7,0 + 2x. 36,5=9,2+ 44x+18x → x= 0,2 mol→ VCO2= 0,2.22,4= 4,48 lít

\(n_{H_2}=\dfrac{13.44}{22.4}=0.6\left(mol\right)\)
\(n_{M\left(pu\right)}=a\left(mol\right)\)
Bảo toàn e :
\(na=0.15\cdot4+0.6\cdot2=1.8\)
\(a=\dfrac{1.8}{n}\)
\(M=\dfrac{16.2}{\dfrac{1.8}{n}}=9n\)
\(n=3\Rightarrow M=27.M:Al\)

\(n_{Zn}=\dfrac{9,75}{65}=0,15\left(mol\right)\)
PTHH: Zn + 2HCl → ZnCl2 + H2
Mol: 0,15 0,15
\(V_{H_2}=0,15.22,4=3,36\left(l\right)\)

a) $n_{H_2} = \dfrac{2,479}{24,79} = 0,1(mol)$
$M + 2HCl \to MCl_2 + H_2$
Theo PTHH :
$n_M = n_{H_2} = 0,1(mol) \Rightarrow M = \dfrac{13,7}{0,1} = 137(Bari)$
b) $n_{HCl} = 2n_{H_2} = 0,2(mol) \Rightarrow x = \dfrac{0,2}{0,2} = 1M$
c) $n_{BaCl_2} = n_{H_2} = 0,1(mol)$
$\Rightarrow m_{BaCl_2} = 0,1.208 = 20,8(gam)$

Đáp án C
Gọi công thức của hai muối trong hỗn hợp ban đầu là A2CO3 và BCO3.
Có các phản ứng:
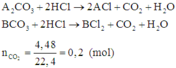
Quan sát phản ứng thấy khi cho hỗn hợp phản ứng với dung dịch HCl thì mỗi gốc C O 3 2 - trong muối được thay thế bởi hai gốc Cl-.
Có 1 mol C O 3 2 - bị thay thế bởi 2 mol Cl- thì khối lượng của muối tăng: (2.35,5 -60) = 11(gam)
Do đó khối lượng muối khan thu được khi cô cạn dung dịch là:
mmuối clorua = mmuối cacbonat + 0,2.11 = 23,8 + 0,2.11= 26 (gam)

Đáp án D
Đặt nNO = x; nN2O = y ⇒ nZ = x + y = 0,005 mol; mZ = 30x + 44y = 0,005 × 19,2 × 2.
||⇒ giải hệ có: x = 0,002 mol; y = 0,003 mol || nMg dư = nH2 = 0,005 mol
⇒ nAg = (0,336 – 0,005 × 24) ÷ 108 = 0,002 mol. Đặt nMg phản ứng = a. Bảo toàn electron:
2nMg phản ứng = 3nNO + 8nN2O + 8nNH4NO3 + nAg ⇒ nNH4NO3 = (0,25a – 0,004) mol
||⇒ mmuối = 148a + 80.(0,25a – 0,004) = 3,04(g) ⇒ a = 0,02 mol. Lại có:
ne = nH+ = nHNO3 = 4nNO + 10nN2O + 10nNH4NO3 = 0,048 mol ⇒ t = 2316(s)

Đáp án D
Vì Mg + dung dịch X → N2O và NO ⇒ X có chứa HNO3.
+ Nhận thấy 0,036 gam hỗn hợp kim loại chính là Ag và Mg.
⇒ X chứa AgNO3 dư và nMg dư = 0,005 mol ⇒ nAg = 0,002 mol
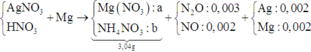
+ PT theo bảo toàn e ta có: 2nMg = nAg + 8nNH4+ + 8nN2O + 3nNO.
<=> 2a – 8b = 0,032 (1).
+ PT theo khối lượng muối: 148a + 80b = 3,04 (2).
+ Giải hệ (1) và (2) ⇒ nMg pứ = 0,02 và nNH4NO3 = 0,001.
⇒ Bảo toàn nitơ ta có nHNO3/X = 0,048 mol.
⇒ t = 0,048 × 96500 ÷ 2 = 2316s
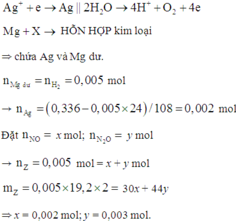
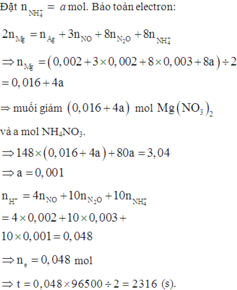

Gọi kim loại cần tìm là R
$R + 2HCl \to RCl_2 + H_2$
Theo PTHH : $n_R = n_{H_2} = \dfrac{5,6}{22,4} = 0,25(mol)$
$M_R = \dfrac{10}{0,25} = 40$
Suy ra, kim loại cần tìm là Canxi
HOẶC LÀ
A + 2H2O --> A(OH)2 + H2
0,25 0,25
nH2 = V/22,4 = 5,6/22,4 = 0,25 mol
MA = m/n = 10/0,25 = 40
=> A là Canxi