Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Z n + H 2 S O 4 → Z n S O 4 + H 2
Cu không tác dụng với axit Sunfuric.
⇒ n Z n = n H 2 = 2,24/22,4 = 0,1 mol
⇒ m Z n = 0,1.65 = 6,5g
⇒ m C u = m r a n c o n l a i = 10,5 - 6,5 =4g
⇒ Chọn B.

\(n_{H_2}=\dfrac{2,24}{22,4}=0,1(mol)\\ a,PTHH:Zn+H_2SO_4\to ZnSO_4+H_2\)
\(b,\) Vì Cu ko td \(H_2SO_4\) loãng nên chất rắn còn lại sau p/ứ bằng \(m_{Cu}\)
\(n_{Zn}=n_{H_2}=0,1(mol)\\ \Rightarrow m_{Zn}=0,1.65=6,5(g)\\ \Rightarrow m_{\text{rắn dư}}=m_{Cu}=10,5-6,5=4(g)\)

$Zn + H_2SO_4 \to ZnSO_4 + H_2$
Theo PTHH :
$n_{Zn} = n_{H_2} = \dfrac{2,24}{22,4} = 0,1(mol)$
$\Rightarrow m_{Cu} = 10,5 - 0,1.65 = 4(gam)$

Câu 2:
\(2Al+3H_2SO_4\rightarrow Al_2\left(SO_4\right)_3+3H_2\\ n_{H_2}=\dfrac{13,44}{22,4}=0,6\left(mol\right)\\ n_{Al}=\dfrac{2.0,6}{3}=0,4\left(mol\right)\\ \%m_{Al}=\dfrac{0,4.27}{12}.100\%=90\%\Rightarrow\%m_{Ag}=100\%-90\%=10\%\)
Câu 3:
\(n_{H_2}=\dfrac{0,6}{2}=0,3\left(mol\right)\\ 2Al+6HCl\rightarrow2AlCl_3+3H_2\\ Al_2O_3+6HCl\rightarrow2AlCl_3+3H_2O\\ n_{Al}=\dfrac{2}{3}.0,3=0,2\left(mol\right)\\ n_{Al_2O_3}=\dfrac{25,8-0,2.27}{102}=0,2\left(mol\right)\\ n_{AlCl_3}=n_{Al}+2n_{Al_2O_3}=0,2+2.0,2=0,6\left(mol\right)\\ m_{AlCl_3}=133,5.0,6=80,1\left(g\right)\)

Cu ko phản ứng với H2SO4 loãng
\(Zn+H_2SO_4\rightarrow ZnSO_4+H_2\)
\(n_{H_2}=\dfrac{2,24}{22,4}=0,1\left(mol\right)\)
\(\Rightarrow m_{Zn}=0,1.65=6,5\left(g\right)\Rightarrow m_{Cu}=4\left(g\right)\)
\(\Rightarrow\%Zn=\dfrac{6,5}{10,5}=62\%;\%Cu=100\%-62\%=28\%\)
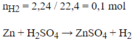
a) PTHH :
\(Zn+H2SO4->ZnSO4+H2\uparrow\)
\(\dfrac{2,24}{22,4}mol...\dfrac{2,24}{22,4}mol..............\dfrac{2,24}{22,4}mol\)
b) Khối lượng chất rắn còn lại là :
mCu = mhh - mZn = 10,5 - 0,1.65 = 4(g)
Vậy...