Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Số mol AlCl3 là nAlCl3 = 0,1. 1 = 0,1 (mol)
Số mol Al2O3 là nAl2O3 = 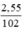 = 0,025 (mol)
= 0,025 (mol)
AlCl3 + 3NaOH → Al(OH)3 + 3NaCl (1)
0,1(mol) 0,1(mol)
2Al(OH)3 + 2NaOH → 2NaAlO2 + 3H2O (2)
0,05(mol)
2 Al(OH)3 -to→ Al2O3 + 3H2O (3)
0,05(mol) 0,025(mol)
Theo pt(3) ta thấy nAl(OH)3 = 2. nAl2O3 = 2. 0,025 = 0,05 (mol)
Như vậy đã có: 0,1 - 0,05 = 0,05 (mol) Al(OH)3 đã bị hòa tan ở pt (2)
Từ (1) và (2) số mol NaOH = 3.0,1 + 0,05 = 0,35 (mol)
Nồng độ mol/l C(M(NaOH)) = 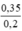 = 1,75M
= 1,75M

$n_{Al_2O_3} = \dfrac{2,55}{102} = 0,025(mol) \Rightarrow n_{Al(OH)_3} = 0,025.2 = 0,05(mol)$
$n_{AlCl_3} = 0,1(mol)$
TH1 : $AlCl_3$ dư
$n_{NaOH} = 3n_{Al(OH)_3} = 0,05.3 = 0,15(mol) \Rightarrow C_{M_{NaOH}} = \dfrac{0,15}{0,2} = 0,75M$
TH2 : Kết tủa bị hòa tan một phần
$n_{NaOH} = 4n_{AlCl_3} - n_{Al(OH)_3} = 0,1.4 - 0,05 = 0,35(mol)$
$\Rightarrow C_{M_{NaOH}} = \dfrac{0,35}{0,2} = 1,75M$

Bài 1:
A + Cl2 → ACl2 (1)
Fe + ACl2 → FeCl2 + A (2)
x x x (mol)
gọi số mol của Fe phản ứng với một số mol của ACl2 là x
khối lương thanh sắt sau phản ứng là:11,2 - 56x + xMA = 12
=> x =
Ta có:
= 0,25.0,4 = 0,1 (mol)
=> MA = 64 g/mol; Vậy kim loại A là Cu
= nCu =
= 0,2 (mol) =>
= 0,5M
bài 2:
(C17H35COO)3C3H5 + 3NaOH -> 3 C17H35COONa + C3H5(OH)3
890 kg 918 kg
x kg 720 kg
=> x = 698,04 kg.

Đặt a, b, c là số mol Al203, CuO , FeO mA = 102a + 80b + 72c = 20,3 m rắn = 102a + 64b + 56c = 17,1 nHCl = 6a + 2b + 2c = 0,7 -> a = 0,05 ; b = c = 0,1 Trong B chứa nCO2 = b + c = 0,2 nCaCO3 = 0,1 -> nCa(HCO3)2 = 0,05 -> nCa(OH)2 = 0,15 -> Vdd =105 ml

a) Đặt \(\hept{\begin{cases}n_{Al}=x\left(mol\right)\\n_{Cu}=y\left(mol\right)\end{cases}}\)
PTHH : \(2Al+3H_2SO_4-->Al_2\left(SO_4\right)_3+3H_2\) (1)
\(Al+6HNO_3-->Al\left(NO_3\right)_3+3NO_2+3H_2O\) (2)
\(Cu+4HNO_3-->Cu\left(NO_3\right)_2+2NO_2+2H_2O\) (3)
Theo pthh (1) : \(n_{Al}=\frac{2}{3}n_{H_2}=0,2\left(mol\right)\) => \(x=0,2\left(mol\right)\)
Theo ptr (2); (3) : \(n_{NO_2}=3n_{Al}+2n_{Cu}\)
=> \(0,8=0,2\cdot3+2\cdot n_{Cu}\)
=> \(n_{Cu}=0,1\left(mol\right)\)
=> \(a=0,2\cdot27+0,1\cdot64=11,8\left(g\right)\)
b) PTHH : \(NH_3+HNO_3-->NH_4NO_3\) (4)
\(3NH_3+3H_2O+Al\left(NO_3\right)_3-->Al\left(OH\right)_3\downarrow+3NH_4NO_3\) (5)
\(2NH_3+2H_2O+Cu\left(NO_3\right)_2-->Cu\left(OH\right)_2\downarrow+2NH_4NO_3\) (6)
BT Al : \(n_{Al\left(OH\right)_3}=n_{Al}=0,2\left(mol\right)\)
BT Cu : \(n_{Cu\left(OH\right)_2}=n_{Cu}=0,1\left(mol\right)\)
=> \(m\downarrow=m_{Al\left(OH\right)_3}+m_{Cu\left(OH\right)_2}=25,4\left(g\right)\)
c) Gọi tên KL là X .
PTHH : \(2Al\left(NO_3\right)_3-t^o->Al_2O_3+6NO_2+\frac{3}{2}O_2\) (7)
\(Cu\left(NO_3\right)_2-t^o->CuO+2NO_2+\frac{1}{2}O_2\) (8)
\(4NO_2+O_2+2H_2O-->4HNO_3\) (9)
\(3X+4nHNO_3-->3X\left(NO_3\right)_n+nNO+2nH_2O\) (10)
viết ptr rồi, nhưng mik có thắc mắc là cho khí B hấp thụ vô nước => tính đc số mol của hno3, rồi áp vô X là ra, nhưng đề lại cho số mol NO =((( hoặc có thể dùng số mol NO để tính nhưng như thế có hơi thừa ko ? tính ra theo 2 cách thì cx ra 2 kq khác nhau ? ai githich giùm mik, hay mik tính sai hoặc phân tích đề sai nhỉ ?? :D

nCa2+ = nCaCO3 = nCaO = 0 . 28 56 = 0 . 005 ⇒ [Ca2+] = 0 , 005 0 , 1 = 0 , 5 M ⇒ Chọn A.
 với các chất sau:
với các chất sau: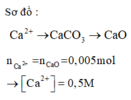
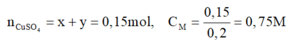
Giải:
nAlCl3 = 0,1.1 = 0,1 (mol); nAl2O3 =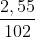 = 0,025 (mol)
= 0,025 (mol)
Có hai trường hợp:
a)NaOH thiếu.
AlCl3 + 3NaOH → Al(OH)3 ↓ + 3NaCl (1)
0,05.3 0,05 (mol)
2Al(OH)3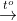 Al2O3 + 3H2O (2)
Al2O3 + 3H2O (2)
0,05 0,025 (mol)
=>CM (NaOH) =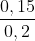 = 0,75 (M).
= 0,75 (M).
b) NaOH dư một phần.
AlCl3 + 3NaOH → Al(OH)3 ↓ + 3NaCl (1)
0,1 0,3 0,1 (mol)
Al(OH)3 + NaOH → NaAlO2 + 2H2O (2)
0,05 0,05 (mol)
2Al(OH)3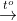 Al2O3 + 3H2O (3)
Al2O3 + 3H2O (3)
0,05 0,025 (mol)
=> nNaOH = 0,3 + 0,05 = 0,35 (mol); CM (NaOH) =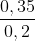 = 1,75 (M).
= 1,75 (M).