Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Ta có nH2SO4 = 0,2 . 1,5 = 0,3 ( mol )
nBa(OH)2 = 0,3 . 0,8 = 0,24 ( mol )
H2SO4 + Ba(OH)2 → BaSO4 + 2H2O
0,3...........0,24
⇒Lập tỉ số 0,3/1:0,24/1 = 0,3 > 0,24
⇒Sau phản ứng H2SO4 dư , Ba(OH)2 hết
⇒mBaSO4 = 0,24 . 233 = 55,92 ( gam )
⇒nH2SO4 dư = 0,3 - 0,24 = 0,06 ( mol )
⇒CM H2SO4 dư = 0,06 : 0,5 = 0,12 M

Câu 7 :
\(n_{H2SO4}=0,1.1=0,1\left(mol\right)\)
Pt : \(H_2SO_4+2NaOH\rightarrow Na_2SO_4+2H_2O\)
\(n_{NaOH}=2n_{H2SO4}=2.0,1=0,2\left(mol\right)\Rightarrow V_{ddNaOH}=\dfrac{0,2}{1}=0,2\left(l\right)=200\left(ml\right)\)
Câu 8 :
\(n_{H2SO4}=0,5.0,7=0,35\left(mol\right)\)
Pt : \(H_2SO_4+2KOH\rightarrow K_2SO_4+H_2O\)
\(n_{KOH}=2n_{H2SO4}=2.0,35=0,7\left(mol\right)\)
\(\Rightarrow m_{ddKOH}=\dfrac{0,7.56}{12\%}.100\%=326,67\left(g\right)\)
\(\Rightarrow V_{ddKOH}=\dfrac{326,67}{1,15}=284,06\left(ml\right)\)
Câu 12 :
a) \(2Cu+O_2\xrightarrow[]{t^o}2CuO\)
\(CuO+2HCl\rightarrow CuCl_2+H_2O\)
\(CuCl_2+2NaOH\rightarrow Cu\left(OH\right)_2+2NaCl\)
\(Cu\left(OH\right)_2\xrightarrow[]{t^o}CuO+H_2O\)
\(CuO+H_2SO_4\rightarrow CuSO_4+H_2O\)
\(CuSO_4+Fe\rightarrow FeSO_4+Cu\downarrow\)
b) \(MgSO_4+2KOH\rightarrow Mg\left(OH\right)_2+K_2SO_4\)
\(Mg\left(OH\right)_2\xrightarrow[]{t^o}MgO+H_2O\)
\(MgO+2HCl\rightarrow MgCl_2+H_2O\)
\(MgCl_2+2AgNO_3\rightarrow Mg\left(NO_3\right)_2+2AgCl\)
\(Mg\left(NO_3\right)_2+Na_2CO_3\rightarrow MgCO_3+2NaNO_3\)
\(MgCO_3\xrightarrow[]{t^o}MgO+CO_2\)
c) \(2Na+2H_2O\rightarrow2NaOH+H_2\)
\(NaOH=HCl\rightarrow NaCl+H_2O\)
\(2NaCl+2H_2O\xrightarrow[cmn]{đpdd}2NaOH+H_2+Cl_2\)
\(Cl_2+H_2\xrightarrow[]{as}2HCl\)
\(HCl+Fe\rightarrow FeCl_2+H_2\)
\(FeCl_2+2NaOH\rightarrow Fe\left(OH\right)_2+2NaCl\)
\(Fe\left(OH\right)_2+H_2SO_4\rightarrow FeSO_4+2H_2O\)
\(FeSO_4+BaCl_2\rightarrow FeCl_2+BaSO_4\)
\(FeCl_2+2AgNO_3\rightarrow Fe\left(NO_3\right)_2+2AgCl\)
\(Fe\left(NO_3\right)_2+Mg\rightarrow Mg\left(NO_3\right)_2+Fe\)
e) \(4Al+3O_2\xrightarrow[]{t^o}2Al_2O_3\)
\(Al_2O_3+6HCl\rightarrow2AlCl_3+3H_2O\)
\(Al_2\left(SO_4\right)_3+6KOH\rightarrow2Al\left(OH\right)_3+3K_2SO_4\)
\(Al\left(OH\right)_3+3HNO_3\rightarrow Al\left(NO_3\right)_3+3H_2O\)
\(Al\left(NO_3\right)_2+Mg\rightarrow Mg\left(NO_3\right)_2+Âl\)
\(2Al+3Cl_2\xrightarrow[]{t^o}2AlCl_3\)
Bạn xem đề chỗ AlCl3 ra Al2(SO4)3 nhé

\(a)n_{NaOH}=0,5.0,2=0,1mol\\ n_{H_2SO_4}=0,3.1=0,3mol\\2 NaOH+H_2SO_4\rightarrow Na_2SO_4+2H_2O\\ \Rightarrow\dfrac{0,1}{2}< \dfrac{0,3}{1}\Rightarrow H_2SO_4.dư\\ 2NaOH+H_2SO_4\rightarrow Na_2SO_4+2H_2O\)
0,1 0,05 0,05 0,1
\(C_M\) \(_{Na_2SO_4}=\dfrac{0,05}{0,2+0,3}=0,1M\)
\(C_M\) \(_{H_2SO_4}=\dfrac{0,3-0,05}{0,2+0,3}=0,5M\)
b) Vì H2SO4 dư nên quỳ tím hoá đỏ.

\(H_2SO_4+2NaOH\rightarrow Na_2SO_4+H_2O\)
\(a\) \(2a\)
\(H_2SO_4+2KOH\rightarrow K_2SO_4+H_2O\)
\(b\) \(2b\)
Sau pư (1) đổi màu quỳ tìm \(\Rightarrow H_2SO_4\) dư \(n_{KON}=0,02.0,5=0,01\left(mol\right)\)
\(\rightarrow n_{H_2SO_4dư}=\frac{1}{2}n_{KOU}=5.10^{-3}\left(MOL\right)\)
\(\rightarrow n_{H_2O_4\text{ban đầu }}=0,05.1=0,05\left(mol\right)\)
\(\rightarrow n_{H_2SO_4\left(\text{pư 1 }\right)}=0,05-5.10^{-3}=0,045\left(mol\right)\)
\(\rightarrow n_{NaOH}=0,045.2=0,09\left(mol\right)\)
\(\rightarrow CM_{NaOH}=\frac{0,09}{0,05}=1,8\left(M\right)\)

100ml = 0,1l
Số mol của dung dịch axit sunfuric
CMH2SO4 = \(\dfrac{n}{V}\Rightarrow n=C_M.V=2.0,1=0,2\left(mol\right)\)
100ml = 0,1l
Số mol của dung dịch bari nitrat
CMBa(NO3)2 = \(\dfrac{n}{V}\Rightarrow n=C_M.V=1.0,1=0,1\left(mol\right)\)
Pt : H2SO4 + Ba(NO3)2 → 2HNO3 + BaSO4\(|\)
1 1 2 1
0,2 0,1 0,2
Lập tỉ số so sánh : \(\dfrac{0,2}{1}>\dfrac{0,1}{1}\)
⇒ H2SO4 dư , Ba(NO3)2 phản ứng hết
⇒ Tính toán dựa vào số mol của Ba(NO3)2
Số mol của axit nitric
nHNO3 = \(\dfrac{0,1.2}{1}=0,2\left(mol\right)\)
Số mol dư của dung dịch axit sunfuric
ndư = nban đầu - nmol
= 0,2 - (0,1. 1)
= 0,1 (mol)
Thể tích của dung dịch sau phản ứng
Vdung dịch sau phản ứng = 0,1 + 0,1
= 0,2 (l)
Nồng độ mol của axit nitric
CMHNO3 = \(\dfrac{n}{V}=\dfrac{0,2}{0,2}=1\left(M\right)\)
Nồng độ mol của dung dịch axit sunfuric
CMH2SO4 = \(\dfrac{n}{V}=\dfrac{0,1}{0,2}=0,5\left(M\right)\)
⇒ Chọn câu : D
Chúc bạn học tốt

200ml= 0,2l
Số mol của dung dịch canxi hidroxit
CMCa(OH)2 = \(\dfrac{n}{V}\Rightarrow n=C_M.V=1.0,2=0,2\left(mol\right)\)
Pt : Ca(OH)2 + 2HCl → CaCl2 + 2H2O\(|\)
1 2 1 1
0,2 0,4
Số mol của dung dịch axit clohidric
nHCl = \(\dfrac{0,2.2}{1}=0,4\left(mol\right)\)
Thể tích của dung dịch axit clohidric
CMHCl = \(\dfrac{n}{V}\Rightarrow V=\dfrac{n}{C_M}=\dfrac{0,4}{1}=0,4\left(l\right)\)
= 400 (l)
⇒ Chọn câu : D
Chúc bạn học tốt
Mình xin lỗi bạn nhé , bạn sửa lại đơn vị giúp mình :
'400 l ' thành '400 ml'

nCaCO3=8,4:(40+12+16.3)=0,084 mol
nH2SO4= 0,5.1=0,5 mol
PTHH: H2SO4+ CaCO3 --> CaSO4↓ + CO2 +H2O
theo đề: 0,5 mol: 0,084 mol
=> H2SO4 de theo CaCO3
phản ứng : 0,084mol<----0,084 mol---> 0,084mol
=> CM=\(\frac{0,084}{0,5}=0,168M\)

Chọn D
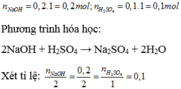
=> NaOH và H 2 S O 4 phản ứng vừa đủ với nhau
=> dung dịch thu được có môi trường trung tính => không làm thay đổi màu quỳ tím.
\(n_{NaOH}=0,1.1=0,1\left(mol\right)\)
\(n_{H_2SO_4}=0,1.1=0,1\left(mol\right)\)
PT: \(2NaOH+H_2SO_4\rightarrow Na_2SO_4+H_2O\)
Xét tỉ lệ: \(\dfrac{0,1}{2}< \dfrac{0,1}{1}\), ta được H2SO4 dư.
→ Quỳ tím hóa đỏ.