Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

C đúng
nH2 = 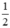 = 0,5 mol.
= 0,5 mol.
Mg + 2HCl → MgCl2 + H2
Fe + 2HCl → FeCl2 + H2
nMg = x; nFe = y.
nH2 = x + y = 0,5 mol.
mhh = 24x + 56y = 20g.
Giải hệ phương trình ta có x = y =0,25 mol.
mMgCl2 = 0, 25 × 95 = 23,75g.
mFeCl2 = 0,25 × 127 = 31,75g
Khối lượng muối clorua = 23,75 + 31,75= 55,5

Đáp án B
Số mol S là: n S = 9 , 6 32 = 0 , 3 mol
Đặt số mol các chất trong X là Fe : a mol ; Mg : b mol


+ HCl và Cl2 đều đóng vai trò chất oxi hóa, mấu chốt của bài toán ta cần nhận ra được: Zn, Mg có hóa trị không đổi; Fe có nhiều hóa trị, cụ thể khi tác dụng với dung dịch thu được muối sắt (II), còn khi tác dụng với Cl2 thu được muối sắt (III).
+ Sử dụng công thức tính nhanh số mol Fe trong X:
![]()
![]()
![]()
Đáp án D

Đáp án D
Bảo toàn e:
+) X + HCl: 2nZn + 2nMg + 2nFe = 2nH2 = 1,0 mol
+) X + Cl2: 2nZn + 2nMg + 3nFe = 2nCl2 = 1,1 mol( khi phản ứng với Cl2, Fe thể hiện hóa trị 3)
⇒ nFe = 1,1 - 1,0 = 0,1 mol ⇒ mFe = 5,6 g

Gọi số mol Mg, Fe, Al là a, b, c
=> 24a + 56b + 27c = 23,8
PTHH: Mg + 2HCl --> MgCl2 + H2
a------------------------->a
Fe + 2HCl --> FeCl2 + H2
b------------------------->b
2Al + 6HCl --> 2AlCl3 + 3H2
c------------------------->1,5c
=> a + b + 1,5c = \(\dfrac{17,92}{22,4}=0,8\left(mol\right)\)
PTHH: Mg + Cl2 --to--> MgCl2
a-->a
2Fe + 3Cl2 --to--> 2FeCl3
b--->1,5b
2Al + 3Cl2 --to--> 2AlCl3
c--->1,5c
=> \(a+1,5b+1,5c=\dfrac{20,16}{22,4}=0,9\left(mol\right)\)
=> a = 0,3; b = 0,2; c = 0,2
=> \(\left\{{}\begin{matrix}m_{Mg}=0,3.24=7,2\left(g\right)\\m_{Fe}=0,2.56=11,2\left(g\right)\\m_{Al}=0,2.27=5,4\left(g\right)\end{matrix}\right.\)



\(Fe+2HCl\rightarrow FeCl_2+H_2\)
x_____________________x
\(Mg+2HCl\rightarrow MgCl_2+H_2\)
y______________________y
Gọi x là số mol của Fe , y là số mol của Mg
\(\Rightarrow56x+24y=10\left(1\right)\)
\(n_{H2}=\frac{5,6}{22,4}=0,25\left(mol\right)\)
\(\Rightarrow n_{H2}=x+y=0,25\left(2\right)\)
\(\left(1\right)+\left(2\right)\Rightarrow\left\{{}\begin{matrix}x=0,125\left(mol\right)\\y=0,125\left(mol\right)\end{matrix}\right.\)
\(\Rightarrow m_{Fe}=0,125.56=7\left(g\right)\)
\(\Rightarrow m_{Mg}=0,125.24=3\left(g\right)\)