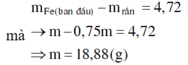Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.



Đáp án C.
nCu = 0,12 mol.
nCu(NO3)2 = nCu = 0,12 mol.
mCu(NO3)2 = 0,12 x 188 = 22,56.

Đáp án C
Nhận thấy khối lượng dung dịch giảm không tỉ lệ với thời gian, ở anot luôn thu được O2 do vậy khối lượng chênh lệch là do Mn+ hết và bị thay thế bằng quá trình điện phân H2O tạo H2.
Ta có: n H 2 = 0 , 0705 m o l
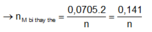
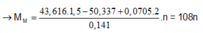

Đáp án B
Ở anot thu được hỗn hợp khí gồm Cl2 và O2, dựa vào tỉ khối ta có tỉ lệ số mol 2 khí này là 6:1.
Gọi số mol O2 là x mol suy ra số mol Cl2 là 6x.
Ở catot thu được Cu 8x mol.
Khối lượng dung dịch giảm là do O2, Cu, Cl2 thoát ra
![]()
Giải được: x=0,03
![]()
Khối lượng kim loại Cu bàm vào catot là 158,36 gam.
Cho Ba(OH)2 dư vào dung dịch sau điện phân kết tủa thu được gồm a mol BaSO4 và a-0,24 mol Cu(OH)2.
![]()
Giải được a=0,48.
Khối lượng chất tan trong X là 97,86 gam.
4,68 gam hỗn hợp Al và Mg có tỉ lệ số mol 2:1 gồm có 0,12 mol Al và 0,06 mol Mg.
Ta có: ![]()
nên lượng khí oxi hóa vừa đủ.
Điện phân X trong 20072 giây tức số mol e là 1,04 mol.
Ở catot thu được Cu 0,48 mol và H2 0,04 mol.
Ở anot thu được Cl2 0,18 mol và O2 0,17 mol.
Tổng số mol khí thoát ra là 0,39 mol

Đáp án D
Vì dung dịch C đã mất màu hoàn toàn nên cả Ag+ và Cu2+ đều phản ứng hết.
Mà B không tan trong HCl nên B chỉ chứa Ag và Cu. Do đó cả Al và Fe đều phản ứng hết.
Suy ra cho X vào A thì cả 4 chất đều phản ứng vừa đủ.
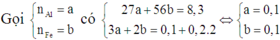
Vì dung dịch E đã nhạt màu nên Ag+ đã phản ứng hết và Cu2+ đã phản ứng một phần.
Do đó D chứa Ag và Cu.
Dung dịch E chứa Al3+, Fe2+ và Cu2+ dư. Khi đó E chứa Fe(OH)2 và Cu(OH)2
Suy ra F chứa Fe2O3 và CuO
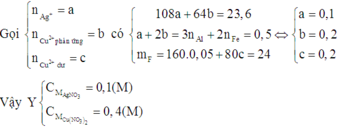

Chọn A
Ta có n e ( trao đổi ) = It 96500 = 0 , 34 mol . Các quá trình điện phân diễn ra như sau:
| Tại catot |
Tại anot |
| Cu2+ + 2e → Cu a mol 2a mol → a mol
|
2Cl- → Cl2 + 2e 0,18 mol 0,09 mol 0,18 mol H2O → 4H+ + O2 + 4e 4b mol ← b mol → 4b mol |
Xét khối lượng giảm sau điện phân ta có:
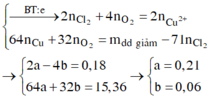
Dung dịch sau điện phân chứa: Na+, H+ (0,24 mol) và NO3- (0,5 mol) và Cu2+ (0,04 mol)
Khi cho dung dịch sau điện phân tác dụng với Fe dư thì: