Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Đáp án A
Số mol NaOH là: n NaOH = 0 , 2 . 0 , 15 = 0 , 03 mol
Dung dịch X chính là dung dịch H2SO4
Trung hoà 100 ml dung dịch X:
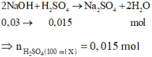
Số mol H2SO4 trong 200 ml dung dịch X là:
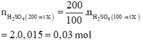
Đặt công thức của oleum là H2SO4.nSO3
Phương trình hoá học:
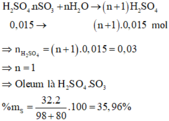

n KOH = 0,05.8 = 0,4(mol)
$2KOH + H_2SO_4 \to K_2SO_4 + 2H_2O$
n H2SO4 = 1/2 n KOH = 0,2(mol)
X : H2SO4.nSO3
$H_2SO_4 + n SO_3 \to H_2SO_4.nSO_3$
$H_2SO_4.nSO_3 + nH_2O \to (n + 1)H_2SO_4$
Theo PTHH :
n X = 1/n .n SO3 = 0,15/n(mol)
n X = 1/(n + 1) .n H2SO4 = 0,2/(n + 1)
Suy ra : 0,15/n = 0,2/(n + 1)
=> n = 3
Vậy X là H2SO4.3SO3
%O = 16.13/338 .100% = 61,54%

H2SO4 + nSO3 => H2SO4.nSO3
H2SO4.nSO3 + nH2O >> n+1H2SO4
H2SO4 + 2NaOH >> Na2SO4 + 2H2O
Số mol NaOH = 0,008 , số mol H2SO4 200ml = 0,008/2 . 200/10 =0,08
Theo (2) nH2SO4.nSO3 =0,08/n+1
MH2SO4.nSO3 =98 +80n = 6,76/0,08/n+1 =84,5n+ 84,5
13,5 =4,5n
=>n=3
%SO3=3.80/2.80+98 =71%
c,Theo câu b , hàm lượng % của SO3 có trong oleum trên là 71
Cứ 100g oleum có 71g SO3 và 29g H2SO4 Khi đó mdd = 1,31.100 = 131g
a g có 71a/100 ...............29a/100
Vì dd H2SO4 có C=40%
Cứ 100g dd có 40g H2SO4 và 60g H2O
=>131g >> 131.40/100 = 52,4g H2SO4 và 131.60/100 = 78,6 g H2O
Khi cho oleum vào dd H2SO4 thì SO3+H2O
SO3 + H2O >> H2SO4
Cứ 80g cần 18g >> 98g
Vậy ..x..g cần 78,6g >>..y..g
x= 78,6.80/18 = 349,3g
y= 78,6.98/18 = 427,9g
Trong loại oleum mới 10% thì mSO3 = 71a/100 -349,3g
và mH2SO4 = 29a/100 +52,4+ 427,9
=> 71a/100 -349,4 / 29a/100 +480,3 = 10/90
=> Bạn ấn máy tìm a nhé

\(CT:H_2SO_4.nSO_3\left(xmol\right)\)
\(SO_3+H_2O\rightarrow H_2SO_4\)
\(xn.............xn\)
\(n_{H_2SO_4}=x+xn=x\left(n+1\right)\left(mol\right)\)
\(n_{NaOH}=2\cdot1=2\left(mol\right)\)
\(2NaOH+H_2SO_4\rightarrow Na_2SO_4+H_2O\)
\(2..................1\)
\(m_X=x\left(98+80n\right)=84.5\left(g\right)\left(1\right)\)
\(n_{H_2SO_4}=x\left(n+1\right)=1\left(mol\right)\left(2\right)\)
\(\dfrac{\left(1\right)}{\left(2\right)}=\dfrac{98+80n}{n+1}=\dfrac{84.5}{1}\)
\(\Leftrightarrow n=3\)
\(CT:H_2SO_4.3H_2O\)
\(x=0.25\)
\(\%S=\dfrac{0.25\cdot4\cdot32}{84.5}\cdot100\%=37.87\%\)

2Na + 2H2O -> 2NaOH + H2 (1)
2K + 2H2O -> 2KOH + H2 (1)
nH2=0,25(mol)
Đặt nNa=a
nK=b
Ta có:
\(\left\{{}\begin{matrix}23a+39b=14,7\\0,5\left(a+b\right)=0,25\end{matrix}\right.\)
=>a=0,3;b=0,2
mNa=23.0,3=6,9(g)
mK=39.0,2=7,8(g)
%mNa=\(\dfrac{6,9}{14,7}.100\%=47\%\)
%mK=100-47=53%
b;
NaOH + HCl -> NaCl + H2O (3)
KOH + HCl -> KCl + H2O (4)
Theo PTHH 3 và 4 ta có:
nNaOH=nHCl(3)=0,3(mol)
nKOH=nHCl(4)=0,2(mol)
CM dd HCl=\(\dfrac{0,5}{0,25}=2M\)

Gọi CT oleum là H2SO4.nSO3 a mol
Hòa tan vào H2O tổng nH2SO4=a+an mol
nNaOH cần=0,2 mol
SO3 + H2O =>H2SO4
an mol =>an mol
H2SO4 +2 NaOH =>Na2SO4 + 2H2O
0,1 mol<=0,2 mol
=>a+an=0,1
Mà m oleum=8,6=a(98+80n)
Giải hpt có a=1/30 và an=1/15
=>n=2
CT oleum H2SO4.2SO3

Dung dịch Y gồm Al3+ (a mol), Fe2+ (b mol) —> Cl- (3a + 2b mol).
mX = 27a + 56b + 2,4 = 16,2.
ne = b + (3a + 2b) = 0,21.5.
—> a = 0,2 và b = 0,15.
—>%Fe=\(\dfrac{\text{(56b+2,4})}{16,2}\)=66,67

Chọn B