Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Đáp án C
Cr2O3 + 2Al → t 0 Al2O3 + 2Cr
Phần 2: + NaOH đặc nóng → 0,075 mol H2
![]()
Phần 1: + HCl loãng, nóng → 0,15 mol H2
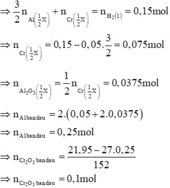
Có 0 , 1 1 < 0 , 25 2 => tính hiệu suất theo lượng Cr2O3 phản ứng.
![]()

Đáp án A
Hỗn hợp rắn gồm Al, Al2O3, Fe với n Fe = 2 n Al 2 O 3 . Chia thành 2 phần không bằng nhau:
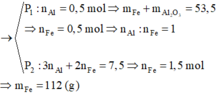

Đáp án C
2Al + 2NaOH + 2H2O → 2NaAlO2 + 3H2
![]()
![]()
2Al + 6HCl → 2AlCl3 + 3H2
Mg + 2HCl → MgCl2 + H2![]()
![]()
![]()

Giải thích:
Gọi số mol của Na và Al trong mỗi phần lần lượt là x và y mol
Nhận xét: Vì hai phần lượng khí H2 thu được chênh lệch nhau và phần 2 nhiều hơn phần 1 => ở phần 1 nhôm phản ứng dư. Mọi tính toán theo số mol của Na
Phần 1:
Na + H2O → NaOH + 0,5H2↑
x →x →0,5x (mol)
Al + NaOH + H2O → NaAlO2 + H2↑
x → 1,5x (mol)
Phần 2:
Na + H2O → NaOH + 0,5H2↑
x →x →0,5x (mol)
Al + NaOH dư + H2O → NaAlO2 + 1,5H2↑
y → 1,5y
Ta có: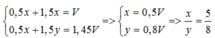
Đáp án A



Phần hai :
$2NaOH+ 2Al + 2H_2O \to 2NaAlO_2 + 3H_2$
$n_{H_2} = \dfrac{10,08}{22,4} = 0,45(mol)$
Theo PTHH : $n_{Al} = \dfrac{2}{3}n_{H_2} = 0,3(ol)$
Phần một :
$2Al + 6HCl \to 2AlCl_3 + 3H_2$
$Fe + 2HCl \to FeCl_2 + H_2$
$n_{H_2} = \dfrac{13,44}{22,4} = 0,6(mol)$
Theo PTHH : $n_{H_2} = \dfrac{3}{2}n_{Al} + n_{Fe}$
$\Rightarrow n_{Fe} = 0,15(mol)$
$\Rightarrow m = 2(0,3.27 + 0,15.56) = 33(gam)$