Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

a) Gọi \(\left\{{}\begin{matrix}n_{Zn}=a\left(mol\right)\\n_{Al}=b\left(mol\right)\end{matrix}\right.\left(\text{Đ}K:a,b>0\right)\)
PTHH: Zn + H2SO4 ---> ZnSO4 + H2
a------>a---------->a----------->a
2Al + 3H2SO4 ---> Al2(SO4)3 + 3H2
b----->1,5b--------->0,5b------->1,5a
=> \(\left\{{}\begin{matrix}65a+27b=20,3\\161b+0,5a.342=65,9\end{matrix}\right.\Leftrightarrow\left\{{}\begin{matrix}a=0,25\\b=0,15\end{matrix}\right.\)
=> \(V=V_{H_2}=\left(0,25+0,15.1,5\right).22,4=10,64\left(l\right)\)
b) \(\left\{{}\begin{matrix}\%m_{Zn}=\dfrac{0,25.65}{20,3}.100\%=80,05\%\\\%m_{Al}=100\%-80,05\%=19,95\%\end{matrix}\right.\)
c) \(m_{\text{dd}H_2SO_4}=\dfrac{\left(0,25+1,5.0,15\right).98}{10\%}=465,5\left(g\right)\)

2Al + F e 2 O 3 → A l 2 O 3 + 2Fe
n H 2 (p1) = 3,08/22,4 = 0,1375 mol
n H 2 (p2) = 0,84/22,4 = 0,0375 mol
Thấy phần 2 tác dụng với NaOH sinh ra khí, suy ra sản phẩm có Al dư.
Vậy rắn Y gồm A l 2 O 3 , Fe và Al dư.
Phần 2:
2Al + 2NaOH + 2 H 2 O
→ 2 N a A l O 2 + 3 H 2
Theo PTPU ta có:
n A l (p2) = 2/3 n H 2 (p2)
= 2/3 . 0,0375 = 0,025 mol
⇒ n A l (p1) = n A l (p2) = 0,025 mol
Phần 1:
Fe + H 2 S O 4 → F e S O 4 + H 2 (*)
2Al + 3 H 2 S O 4
→ A l 2 S O 4 3 + 3 H 2 (**)
Theo (**) ta có:
n H 2 (**) = 3/2 n A l (p1)
= 3/2 . 0,025 = 0,0375 mol
⇒ n H 2 (*) = n H 2 (p1) - n H 2 (**)
= 0,1375 - 0,0375 = 0,1 mol
⇒ n F e (p1) = n H 2 (*)=0,1 mol
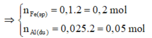
⇒ n A l pư = n F e sp = 0,2 mol
⇒ n F e 2 O 3 = 1/2 . n F e sp
= 1/2 . 0,2 = 0,1 mol
m h h = m F e 2 O 3 + m A l p u + m A l d u
= 0,1.160+0,05.27+0,2.27=22,75g
⇒ Chọn D.



Qui đổi ½ hh B gồm Al (x mol), Fe (y mol), O (z mol)

=> mB = 2 (mAl + mFe + mO) = 102,78g
Gọi công thức của oxit sắt là FeaOb

=> Fe2O3

Đặt a, b, c là số mol Mg, Al, Fe
-> mA = 24a + 27b + 56c = 4,3
Với NaOH =>; nH2 = 1,5b = 0,075
Với HCl =>; nH2 = a + 1,5b + c = 0,135
=>a = 0,01; b = 0,05; c = 0,05
=> A gồm Mg (5,47%), Al (30,75%) và Fe (63,78%)
Al(OH)3 tan trong NaOH dư nên chất rắn còn lại gồm MgO (a) và Fe2O3 (0,5c)
=> m rắn = 4,4 gam
Dễ thấy b = c = 5a nên trong x gam A chứa Mg (y), Al (5y) và Fe (5y)
Bảo toàn electron: 2y + 3.5y + 2.5y = 0,6.3
=>y = 1/15
=>x = 439/15 gam

a)
2Al + 6HCl → 2AlCl3 + 3H2↑
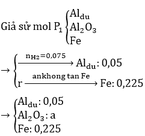
Pt: 2Al + 6H2SO4 → Al2(SO4)3 + 3SO2↑ + 6H2O
2Fe + 6H2SO4 → Fe2(SO4)3 + 3SO2↑ + 6H2O
Al2O3 + 3H2SO4 → Al2(SO4)3 + 3H2O
Giả sử P2 = kP1
=> a=0.1
=> m = 128,8g
b)
2yAl + 3FexOy → yAl2O3 + 3xFe
0,1 0,225
=> 0,225y = 0,3x => 3y = 4x
=> Fe3O4
P1:
Gọi a là số mol của Ba
Ba + 2H2O ----> Ba(OH)2 + H2
a 2a a a (mol)
Vì số mol H2 ở P2 lớn hơn P1 => Al ở P1 phản ứng dư
2Al + 2H2O + Ba(OH)2 ----> Ba(AlO2)2 + 3H2
2a a 3a (mol)
=> 4a = 0,04 => a = 0,01
=> nBa(OH)2 = 0,01 (mol)
P2:
Ba ----> H2
0,01 0,01
Al ----> \(\frac{3}{2}\)H2
0,04 0,06
P3:
Ba + H2SO4 ----> BaSO4 + H2
0,01 0,02 0,01 0,01 (mol)
2Al + 3H2SO4 ----> Al2(SO4)3 + 3H2
0,04 0,06 0,02 0,06 (mol)
Fe + H2SO4 ----> FeSO4 + H2
0,02 0,02 0,02 0,02 (mol)
Y : BaSO4, Al2(SO4)3, FeSO4
tính m rồi tính C%