Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Đáp án : C
Coi mỗi phần hỗn hợp oxit gồm FeO và Fe2O3 với số mol là a và b
=> Muối P1 có a mol FeCl2 và 2b mol FeCl3
=> 72a + 160b = 156,8.0,5 = 78,4 và 127a + 325b = 155,4
=> a = 0,2 ; b = 0,4 mol => nCl- (muối 1) = 2,8 mol
Xét cả quá trình thì : muối phần 2 chính là muối phần 1 có 1 lượng SO42- thay thế cho Cl-
Cứ x mol SO42- thay thế cho 2x mol Cl-
=> mmuối 2 - mmuối 1 = 96x – 35,3.2x = 167,9 – 155,4 => x = 0,5 mol
=> Số mol Cl bị thay thế là 1,0 mol => số mol Cl trong muối 2 = 2,8 – 1,0 = 1,8 mol

Đáp án : B
Xét P1 và P2 : khi số mol HCl tăng thì khối lượng rắn tăng => ở P1 HCl thiếu
=> mrắn – mP1 = mCl pứ => nCl pứ = 0,5 mol = nHCl = 0,5a
=> a = 1 M
Gọi số mol Zn , Mg , Fe trong mỗi phần lần lượt là x , y , z
+) P2 : mrắn – mP2 = mCl pứ => nCl pứ = 0,7 mol < nHCl => kim loại phản ứng hết
=> 2x + 2y + 2z = 0,7 mol
+) P3 : nAg = 2nZn + 2nMg + nFe => 2x + 2y + 3z = 0,8 mol
,mmỗi P = 65x + 24y + 56z = 15,7g
=> x = z = 0,1 ; y = 0,15 mol
=> %nMg = 42,86%
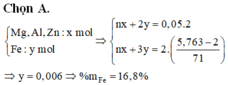
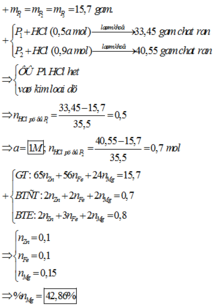



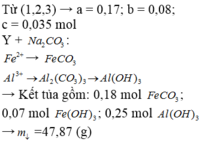
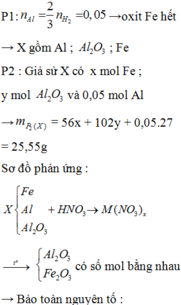
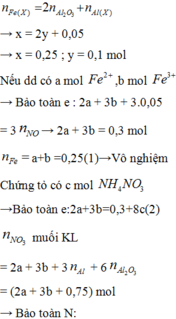
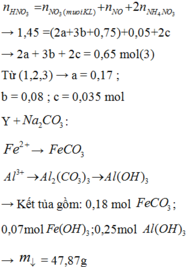



Gọi x,y tương ứng là số mol của FeO và Fe2O3
Ta có: 72x + 160y = 78,4 và 127.x/2 + 325.y/2 = 77,7. Giải hệ thu được: x = 0,2;y = 0,4 mol.
mFeO = 72.0,2 = 14,4 gam; mFe2O3 = 78,4 - 14,4 = 64 gam.
Phần 2:
Gọi a, b tương ứng là số mol của HCl và H2SO4. Hỗn hợp muối khan gồm FeCl2, FeCl3, FeSO4 và Fe2(SO4)3.
Ta có: 83,95 = mFe + mCl + mSO4 = 56(0,1 + 0,4) + 35,5a + 96b = 28 + 35,5a + 96b
Mặt khác: nCl + 2nSO4 = a + 2b = 2nFeO + 6nFe2O3 = 2.0,1 + 6.0,2 = 1,4
Giải hệ thu được: a = 0,9 và b = 0,25 mol.
Vậy: [HCl] = 0,9/0,5 = 1,8M và [H2SO4] = 0,25/0,5 = 0,5M.
mFe =(0.2+0.40)*56