Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

a) Số oxi hóa của S trong các chất: H2, S-2 , S0, H2S+4O3, H2S+6O4
b) Số oxi hóa của Cl trong các hợp chất: HCl-1, HCl+1O, NaCl+3O2, HCl+5O3, HCl+7O4.
c) Số oxi hóa của Mn trong các chất: Mn0, Mn+2Cl2, Mn+4O2, KMn+7O4
d) 

Đặt X là số oxi hoá của nguyên tố ni tơ trong các hợp chất trên ta có
Trong NO: x + (-2) = 0 -> X = +2
Trong NO2: x + 2(-2) = 0 -> x = +4
Trong N2O5 : 2x + 5(-2) = 0 \(\rightarrow\) x = +5
Trong HNO3 : (+1) + x + 3(-2) = 0 \(\rightarrow\) X = +5
Trong HNƠ2 : (+1) + x + 2(-2) = 0 \(\rightarrow\) X = +3
Trong NH3 : X + 3(+l) = 0 \(\rightarrow\) X = -3
Trong NH4Cl: X + 4(+l) + (-1) = 0 \(\rightarrow\) X = -3.
Cũng giải tương tự như trên ta có:
.jpg)
- Đặt x là oxi hóa của nguyên tố nitơ trong các hợp chất trên, ta có:
Trong NO: x + (-2) = 0 → x = +2.
Trong NO2: x + 2(-2) = 0 → x = +4.
Trong N2O5: 2x + 5(-2) = 0 → x = +5.
Trong HNO3: (+1) +x + 3(-3) = 0 → x = +5.
Trong HNO2: (+1) + x +2(-2) = 0 → x = +3.
Trong NH3 : x + 3(+1) = 0 → x = -3.
Trong NH3Cl: x + 4(+1) +(-1) = 0 → x = -3.
- Cũng giải tương tự như trên ta có:

a) Thể tích nước cần dùng để pha loãng.
Khối lượng của 100ml dung dịch axit 98%
100ml × 1,84 g/ml = 184g
Khối lượng H2SO4 nguyên chất trong 100ml dung dịch trên
Khối lượng dung dịch axit 20% có chứa 180,32g H2SO4 nguyên chất.
Khối lượng nước cần bổ sung vào 100ml dung dịch H2SO4 98% để có được dung dịch 20%.
901,6g – 184g = 717,6g
Vì D của nước là 1 g/ml nên thể tích nước cần bổ sung là 717,6 ml.
b) Cách tiến hành khi pha loãng
Khi pha loãng lấy 717,6 ml H2O vào ống đong hình trụ có thể tích khoảng 2 lít. Sau đó cho từ từ 100ml H2SO4 98% vào lượng nước trên, đổ axit chảy theo một đũa thủy tinh, sau khi đổ vài giọt nên dùng đũa thủy tinh khuấy nhẹ đều. Không được đổ nước vào axit 98%, axit sẽ bắn vào da, mắt ... và gây bỏng rất nặng
a) Thể tích nước cần dùng để pha loãng.
Khối lượng của 100ml dung dịch axit 98%
100ml × 1,84 g/ml = 184g
Khối lượng H2SO4 nguyên chất trong 100ml dung dịch trên
Khối lượng dung dịch axit 20% có chứa 180,32g H2SO4 nguyên chất.
Khối lượng nước cần bổ sung vào 100ml dung dịch H2SO4 98% để có được dung dịch 20%.
901,6g – 184g = 717,6g
Vì D của nước là 1 g/ml nên thể tích nước cần bổ sung là 717,6 ml.
b) Cách tiến hành khi pha loãng
Khi pha loãng lấy 717,6 ml H2O vào ống đong hình trụ có thể tích khoảng 2 lít. Sau đó cho từ từ 100ml H2SO4 98% vào lượng nước trên, đổ axit chảy theo một đũa thủy tinh, sau khi đổ vài giọt nên dùng đũa thủy tinh khuấy nhẹ đều. Không được đổ nước vào axit 98%, axit sẽ bắn vào da, mắt ... và gây bỏng rất nặng
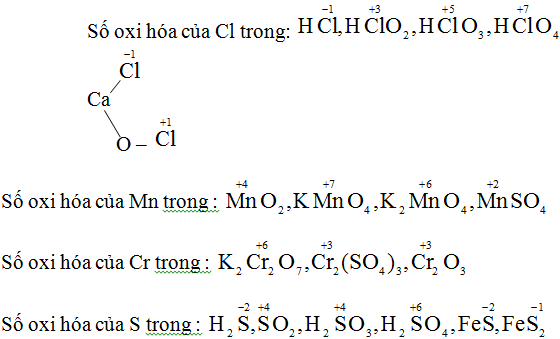
.jpg)

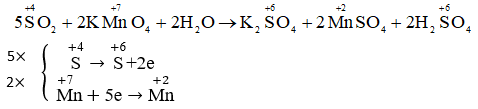
.jpg)