Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

a) Na -> Na+ + 1e ; Cl + 1e -> Cl-
Mg -> Mg2+ + 2e ; S + 2e -> S2-
Al -> Al3+ + 3e ; O + 2e -> O2-
b) Cấu hình electron của các nguyên tử và các ion:
11Na: 1s22s22p63s1 ; Na+: 1s22s22p6
Cấu hình electron lớp ngoài cùng giống Ne.
17Cl: 1s22s22p63s23p5 ; Cl - : 1s22s22p63s23p6
Cấu hình electron lớp ngoài cùng giống Ar.
12Mg: 1s22s22p63s2 ; Mg2+: 1s22s22p6
Cấu hình electron lớp ngoài cùng giống Ne.
16S: 1s22s22p63s23p4 ; S2- : 1s22s22p63s23p6
Cấu hình electron lớp ngoài cùng giống Ar.
13Al: 1s22s22p63s23p51 ; Al3+ : 1s22s22p6
Cấu hình electron lớp ngoài cùng giống Ne.
8O: 1s22s22p4 ; O2- : 1s22s22p6
Cấu hình electron lớp ngoài cùng giống Ne.

F: 2 s 2 2 p 5 ; Cl: 3 s 2 3 p 5 ; Br: 4 s 2 4 p 5 ; I: 5 s 2 5 p 5 ; At: 6 s 2 6 p 5
Nguyên tử của các nguyên tố thuộc nhóm VIIA có 7 electron ở lớp ngoài cùng với cấu hình ns 2 np 5
Vì chỉ kém khí hiếm đứng sau 1 electron nên trong các phản ứng hoá học, các nguyên tử có khuynh hướng thu thêm 1 electron để đạt được cấu hình vững bền của các khí hiếm đứng sau. Do đó, trong các hợp chất với nguyên tố kim loại, các nguyên tố thuộc nhóm VIIA có hoá trị 1.

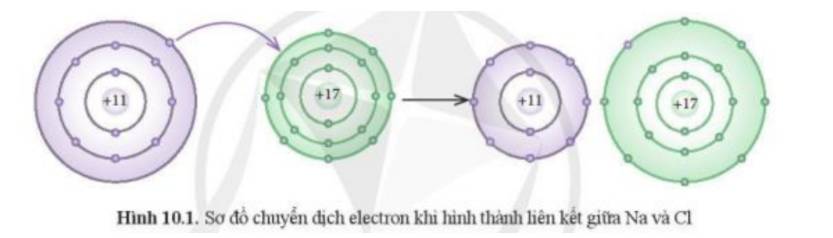
- Theo Hình 10.1 ta thấy:
+ Kim loại Na có 1 electron ở lớp vỏ ngoài cùng => Xu hướng nhường đi 1 electron để đạt cấu hình khí hiếm
+ Phi kim Cl có 7 electron ở lớp vỏ ngoài cùng => Xu hướng nhận thêm 1 electron để đạt cấu hình khí hiếm
=> Cl đã nhận thêm 1 electron từ Na để trở thành các ion
=> Phát biểu (1) phù hợp với sơ đồ phản ứng ở Hình 10.1

Cấu hình electron của các nguyên tử và các ion:
11Na : 1s22s22p63s1; Na+: 1s22s22p6
Cấu hình electron lớp ngoài cùng giống Ne.
17Cl : 1s22s22p63s23p5; Cl-: 1s22s22p63s23p6
Cấu hình electron lớp ngoài cùng giống Ar.
12Mg: 1s22s22p63s2; Mg2+: 1s22s22p6
Cấu hình electron lớp ngoài cùng giống Ne.
16S : 1s22s22p63s23p4; S2-: 1s22s22p63s23p6
Cấu hình electron lớp ngoài cùng giống Ar.
13Al : 1s22s22p63s23p1; Al3+: 1s22s22p6
Cấu hình electron lớp ngoài cùng giống Ne.
8O : 1s22s22p4; O2-: 1s22s22p6
Cấu hình electron lớp ngoài cùng giống Ne.

Ar: 1 s 2 2 s 2 2 p 6 3 s 2 3 p 6
S 2 - : 1 s 2 2 s 2 2 p 6 3 s 2 3 p 6
Cl - : 1 s 2 2 s 2 2 p 6 3 s 2 3 p 6
Nhận xét : Các anion S 2 - , Cl - có cấu hình electron giống cấu hình electron của nguyên tử khí hiếm Ar đứng sau.

a) Na (Z = 11) 1s22s22p63s1 ⇒ Na+: 1s22s22p6.
Cl (Z = 17) 1s22s22p63s23p5 ⇒ Cl-: 1s22s22p63s23p6.
b) Nguyên tử Cl nhận 1 electron để trở thành ion Cl-, electron này xếp vào AO thuộc phân lớp p của Cl. AO đó là AO chứa 1 electron.