Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

\(C_2H_4+Br_2-->C_2H_4Br_2\)
\(m_{C_2H_4Br_2}\left(tt\right)=\dfrac{1.100}{80}=1,25\left(kg\right)=1250\left(g\right)\)
=> \(n_{C_2H_4}=n_{C_2H_4Br_2}=\dfrac{1250}{188}=6,65\left(mol\right)\)
=> \(V_{C_2H_4}=6,65.22,4=148,96\left(l\right)\)


đề sai sai nha !
X là quặng hematit chứa 60% Fe2O3, Y là quặng manhetit chứa 69,6% Fe3O4. Cần trộn X, Y theo tỉ lệ khối lượng như thế nào để được quặng Z mà từ 1 tấn quặng Z có thể điều chế được 0,5 tấn gang chứa 96% sắt?
OK!
Từ một tấn quặng apatit có hàm lượng canxi photphat 90% thì điều chế được bao nhiêu kg supe lân đơn?

Đổi:1 tấn =1000kg
Canxi phột phát (Ca3(PO4)2 ) có trong 1 tấn quặng là:
\(Ca_3\left(PO_4\right)_2=90\%.1000=900\left(kg\right)\)
PTPU điều chế supe lân đơn là:
\(Ca_3\left(PO_4\right)_2+3H_3PO_4\rightarrow3Ca\left(H_2PO_4\right)_2\)
\(n_{Ca3\left(PO4\right)2}=\frac{900}{310}=2,9\left(kmol\right)\)
\(n_{Ca\left(H2PO4\right)2}=3n_{Ca3\left(PO4\right)2}\)
\(\Rightarrow n_{Ca\left(H2PO4\right)2}=3.2,9=8,7\left(kmol\right)\)
\(\Rightarrow m_{Ca\left(H2PO4\right)2}=8,7.234=2035,8\left(kg\right)\)

m t i n h b ộ t = 100 . 81 % = 81 k g .
Ta có quá trình:
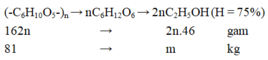

⇒ Chọn C.

Dùng BTKL m = 8,58+1,2-0.92=6,46(kg
m xà phòng = \(\dfrac{6,46}{60}\cdot100\)= 10,77 kg


mCaCO3 = 0.5*90/100=0.45 tấn
CaCO3 -to-> CaO + CO2
100_________56
0.45_________x
x = 0.252 tấn
mCaO thực thu = 0.252*85/100=0.2142 tấn = 214.2 kg
=> D
\(0,5ton=5.10^5\left(g\right)\\ m_{CaCO_3}=5.10^5.\left(100-10\right)=450000\left(g\right)\\ \rightarrow n_{CaCO_3}=\frac{450000}{100}=4500\left(mol\right)\\ PTHH:CaCO_3\underrightarrow{t^o}CaO+CO_2\\ m_{CaO}=4500.56=252000\left(g\right)\\ \rightarrow m_{CaO}=252000.85\%=214200\left(g\right)=214,2\left(kg\right)\\ \rightarrow D\)

m t i n h b o t = 100.81/100 = 81kg
⇒ n t i n h b o t = 81/162 = 0,5 kmol
Vì H = 75% nên ta có:
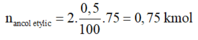
⇒ m a n c o l e t y l i c = 0,75.46 = 34,5 kg
Vì D = 0,8g/ml nên
⇒ V a n c o l e t y l i c = 34,5/0,8 = 43,125 lit
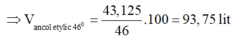
⇒ Chọn C.

m Al2O3=1.51%=0,51(tấn)=510(kg)
2Al2O3--->4Al+3O2
1 mol Al2O3 sản xuất được 2mol nhôm
204g Al2O3 ---------------------54g nhôm
Vậy 510kg-Al2o3 sản xuất dc \(\frac{510.54}{204}=135\left(kg\right)\)
Do H=90%
--> m Al=135.90%=121,5(kg)
thì bạn tính 1m3 C2H4 ứng với ? g thì mPE=mC2H4