Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

a) Đặt số mol của MO, M(OH)2, MCO3 tương ứng là x, y, z.
Nếu tạo muối trung hòa ta có các phản ứng:
MO + H2SO4 →MSO4 + H2O (1)
M(OH)2 + H2SO4 →MSO4 + 2H2O (2)
MCO3 + H2SO4 →MSO4 + H2O + CO2 (3)
Nếu tạo muối axít ta có các phản ứng:
MO + 2H2SO4 →M(HSO4)2 + H2O (4)
M(OH)2 + 2H2SO4 →M(HSO4)2 + 2H2O (5)
MCO3 + 2H2SO4 →M(HSO4)2 + H2O + CO2 (6)
Ta có :
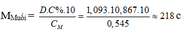
– TH1: Nếu muối là MSO4 M + 96 = 218 M = 122 (loại)
– TH2: Nếu là muối M(HSO4)2 M + 97.2 = 218 M = 24 (Mg)
Vậy xảy ra phản ứng (4, 5, 6) tạo muối Mg(HSO4)2
b) Theo (4, 5, 6) Số mol CO2 = 0,448/22,4 = 0,02 molz = 0,02 (I)
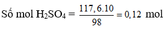
2x + 2y + 2z = 0,12 (II)
Đề bài: 40x + 58y + 84z = 3,64 (III)
Giải hệ (I, II, III): x = 0,02; y = 0,02; z = 0,02
%MgO = 40.0,02.100/3,64 = 21,98%
%Mg(OH)2 = 58.0,02.100/3,64 = 31,87%
%MgCO3 = 84.0,02.100/3,64 = 46,15%

\(n_{FeO}=a\left(mol\right),n_{CuO}=b\left(mol\right)\)
\(m_{hh}=72a+80b=19.2\left(g\right)\left(1\right)\)
\(FeO+H_2SO_4\rightarrow FeSO_4+H_2O\)
\(CuO+H_2SO_4\rightarrow CuSO_4+H_2O\)
\(n_{H_2SO_4}=a+b=0.25\left(mol\right)\left(2\right)\)
\(\left(1\right),\left(2\right):a=0.1,b=0.15\)
\(m_{FeO}=0.1\cdot72=7.2\left(g\right)\)
\(m_{CuO}=12\left(g\right)\)
\(C_{M_{FeSO_4}}=\dfrac{0.1}{0.25}=0.4\left(M\right)\)
\(C_{M_{CuSO_4}}=\dfrac{0.15}{0.25}=0.6\left(M\right)\)

a, Ta có: 27nAl + 56nFe = 22 (1)
PT: \(2Al+6HCl\rightarrow2AlCl_3+3H_2\)
\(Fe+2HCl\rightarrow FeCl_2+H_2\)
Theo PT: \(n_{H_2}=\dfrac{3}{2}n_{Al}+n_{Fe}=\dfrac{19,832}{24,79}=0,8\left(mol\right)\left(2\right)\)
Từ (1) và (2) \(\Rightarrow\left\{{}\begin{matrix}m_{Al}=0,4\left(mol\right)\\n_{Fe}=0,2\left(mol\right)\end{matrix}\right.\)
\(\Rightarrow\left\{{}\begin{matrix}\%m_{Al}=\dfrac{0,4.27}{22}.100\%\approx49,09\%\\\%m_{Fe}\approx50,91\%\end{matrix}\right.\)
b, \(n_{HCl}=2n_{H_2}=1,6\left(mol\right)\)
\(\Rightarrow C_{M_{HCl}}=\dfrac{1,6}{0,5}=3,2\left(M\right)\)

3. CuO +H2SO4 -->CuSO4 +H2O
nCuO=64/80=0,8(mol)
theo PTHH :nCuO =nH2SO4=nCuSO4=0,8(mol)
=>mddH2SO4 20%=0,8.98.100/20=392(g)
mCuSO4=0,8.160=128(g)
mdd sau phản ứng =64 +392=456(g)
mH2O=456 -128=328(g)
giả sử có a g CuSO4.5H2O tách ra
trong 250g CuSO4 tách ra có 160g CuSO4 và 90g H2O tách ra
=> trong a g CuSO4.5H2O tách ra có : 160a/250 g CuSO4 và 90a/250 g H2O tách ra
=>mCuSO4(còn lại)=128 -160a/250 (g)
mH2O (còn lại)=328 -90a/250 (g)
=>\(\dfrac{128-\dfrac{160a}{250}}{328-\dfrac{90a}{250}}.100=25\)
=>a=83,63(g)

a, Ta có: 27nAl + 56nFe = 27,8 (1)
PT: \(2Al+3H_2SO_4\rightarrow Al_2\left(SO_4\right)_3+3H_2\)
\(Fe+H_2SO_4\rightarrow FeSO_4+H_2\)
Theo PT: \(n_{H_2}=\dfrac{3}{2}n_{Al}+n_{Fe}=\dfrac{17,353}{24,79}=0,7\left(mol\right)\left(2\right)\)
Từ (1) và (2) \(\Rightarrow\left\{{}\begin{matrix}n_{Al}=0,2\left(mol\right)\\n_{Fe}=0,4\left(mol\right)\end{matrix}\right.\)
\(\Rightarrow\left\{{}\begin{matrix}\%m_{Al}=\dfrac{0,2.27}{27,8}.100\%\approx19,42\%\\\%m_{Fe}\approx80,58\%\end{matrix}\right.\)
b, \(n_{H_2SO_4}=n_{H_2}=0,7\left(mol\right)\Rightarrow C_{M_{H_2SO_4}}=\dfrac{0,7}{0,5}=1,4\left(M\right)\)

Gọi x, y lần lượt là sô mol của Fe và Mg
Ta có: \(n_{H_2}=\dfrac{6,72}{22,4}=0,3\left(mol\right)\)
PTHH:
Fe + H2SO4 ---> FeSO4 + H2 (1)
Mg + H2SO4 ---> MgSO4 + H2 (2)
a. Theo PT(1): \(n_{H_2}=n_{Fe}=x\left(mol\right)\)
Theo PT(2): \(n_{H_2}=n_{Mg}=y\left(mol\right)\)
\(\Rightarrow x+y=0,3\) (*)
Theo đề, ta có: 56x + 24y = 10.4 (**)
Từ (*) và (**), ta có HPT:
\(\left\{{}\begin{matrix}x+y=0,3\\56x+24y=10,4\end{matrix}\right.\Leftrightarrow\left\{{}\begin{matrix}x=0,1\\y=0,2\end{matrix}\right.\)
\(\Rightarrow m_{Fe}=0,1.56=5,6\left(g\right);m_{Mg}=0,2.24=4,8\left(g\right)\)
b. Ta có: \(n_{hh}=0,1+0,2=0,3\left(mol\right)\)
Theo PT(1,2): \(n_{H_2SO_4}=n_{hh}=0,3\left(mol\right)\)
Đổi 200ml = 0,2 lít
\(\Rightarrow C_{M_{H_2SO_4}}=\dfrac{0,3}{0,2}=1,5M\)

a) Fe +2HCl---> FeCl2 + H2
Cu ko pư nha
nh2= 3.36/22,4=0,15 mol
thế mol h2 vào phương trình ta được
nh2=nfe=0.15
có mol hết rồi thì bạn tìm mfe=0.15x56=8.4(gam)
mcu=mhh-mfe=10-8.4=1.6(gam)
Vì đồng không tác dụng với HCl loãng :
\(n_{H2}=\dfrac{3,36}{22,4}=0,15\left(mol\right)\)
a) Pt : \(Fe+2HCl\rightarrow FeCl_2+H_2|\)
1 2 1 1
0,15 0,15
b) \(n_{Fe}=\dfrac{0,15.1}{1}=0,15\left(mol\right)\)
\(m_{Fe}=0,15.56=8,4\left(g\right)\)
\(m_{Cu}=10-8,4=1,6\left(g\right)\)
c) Cả hai chất đều xảy ra phản ứng :
Pt : \(Cu+H_2SO_{4đặc}\underrightarrow{t^o}CuSO_4+SO_2+H_2O\)
\(2Fe+6H_2SO_{4đặc}\underrightarrow{t^o}Fe_2\left(SO_4\right)_3+3SO_2+6H_2O\)
Chúc bạn học tốt