Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Đáp án D
► Đặt CT chung của A là CnH2n+2O (n ≥ 1), B và C là CmH2mO2 (m > 1).
⇒ Phương trình cháy:
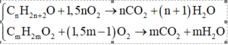
⇒ ∑nB,C = 1,5.∑nCO2 – ∑nO2 = 0,03 mol ⇒ Q gồm 0,03 mol muối và 0,02 mol NaOH dư.
► nNaOH = 0,02 + 0,005 = 0,025 mol || RCOONa + NaOH → t o C a O RH + Na2CO3.
⇒ muối dư, NaOH. Thêm 0,005 mol NaOH ⇄ 0,2 gam NaOH vào để đủ. Bảo toàn khối lượng:
⇒ m = (3,26 + 0,2 + 0,2 – 0,03 × 106) × 0,025 ÷ 0,03 = 0,4(g)

Đáp án D
Z gồm CuO (0,12), NaNO2 (a mol) và NaOH dư (b mol)
=> nNaOH ban đầu = a + b = 0,4 mZ = 80 . 0,12 + 69a + 40b = 34,88
=> a = 0,32 và b = 0,08
Bảo toàn N => nN trong khí = nHNO3 - nNaNO2 = 0,16
Đặt nO trong khí = x
Bảo toàn electron: 0,12 . 2 + 2x = 0,16.5
=> X = 0,28
Vậy khí chứa N (0,16) và O (0,28)
Nếu khí gồm NO và NO2 thì n khí = 0,16 => V = 3,584 lít

Đáp án C
Ta có nO bị lấy đi bởi CO = 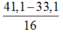 = 0,5 mol
= 0,5 mol
⇒ nCO pứ = nO = 0,5 mol
Bảo toàn e cả quá trình ta có: 2nCO = 2nH2 Û nH2 = nCO = 0,5 mol
⇒ VH2 = 0,5 × 22,4 = 11,2 lít

Giải thích: Đáp án A
A, B, C đều no, đơn chức mạch hở.
Đốt cháy m gam P cần 0,36 mol O2 sinh ra 0,28 mol CO2.
Cho m gam P tác dụng với 0,1 mol NaOH thu được dung dịch Q.
Cô cạn dung dịch Q thu được 7,36 gam rắn khan.
Thực hiện decaboxyl hóa với 0,024 mol NaOH nữa thu được a gam khí.
Ta thấy khi đốt cháy ancol no đơn chức thì số mol O2 tham gia gấp 1,5 lần số mol CO2thu được.
Nhưng khi đốt cháy axit hoặc este no đơn chức thì số mol O2 không gấp 1,5 lần số mol CO2 nữa mà lệch đi một lượng bằng số mol của chất đó
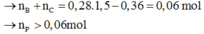
Do vậy m gam P phản ứng với 0,06 mol NaOH nên chất rắn thu được chứa 0,04 mol NaOH dư và 0,06 mol muối của axit B.
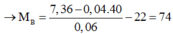
vậy B là C2H5COOH
Thực hiện decacboxyl chất rắn trên thu được 0,06 mol khí C2H6.
→ a = 1,8 gam





\(n_{Fe}=\dfrac{60}{56}=\dfrac{15}{14}\left(mol\right)\)
\(n_S=\dfrac{30}{32}=\dfrac{15}{16}\left(mol\right)\)
Bảo toàn e :
\(2n_{Fe}+4n_S=4n_{O_2}\)
\(\Rightarrow n_{O_2}=1.473\left(mol\right)\)
\(V=33\left(l\right)\)
Ta có: $n_{Fe}=\frac{60}{56}(mol);n_{S}=\frac{30}{32}$
Sau phản ứng Fe dư S hết
Bảo toàn e cho cả quá trình ta có: $n_{O_2}=1,47(mol)$
$\Rightarrow V_{O_2}=32,928(l)$