Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

- Đơn chất oxygen được tạo nên từ 1 nguyên tố là: oxygen (O)
- Hợp chất carbon dioxide được tạo nên từ 2 nguyên tố là: carbon (C) và oxygen (O)
- Oxygen duy trì sự sống và sự cháy. Carbon dioxide không duy trì sự sống và sự cháy

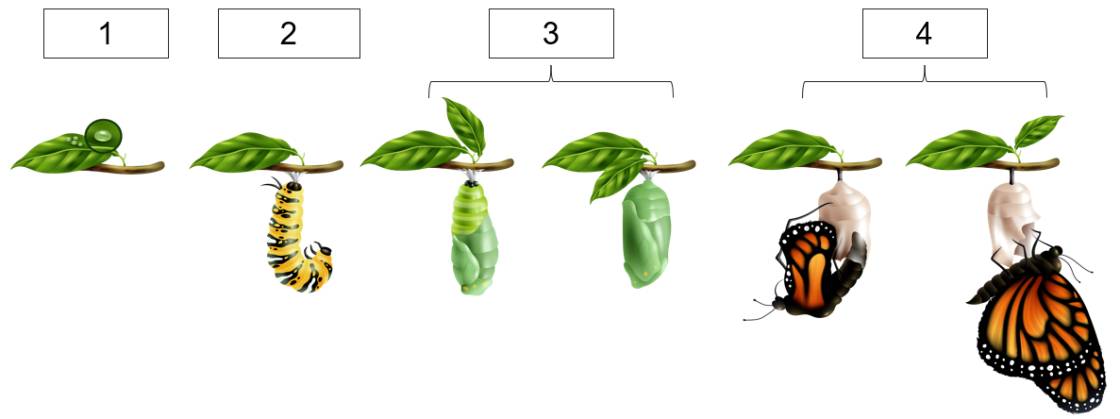
Sinh sản vô tính là một quá trình sinh sản trong đó không có sự kết hợp giữa giao tử đực và giao tử cái. Điều này khác với sinh sản hữu tính, trong đó có sự giao phối giữa hai cá thể để tạo ra hợp tử mới. Trong bài viết này, mời bạn theo dõi để tìm hiểu thêm về hình thức sinh sản này nhé ..........cho mình 1 tick thanks
Sinh sản vô tính là hình thức sinh sản không có sự kết hợp giữa giao tử đực và giao tử cái, con non được sinh ra giống hệt cơ thể mẹ về mặt di truyền. Quá trình này chỉ cần một cá thể và thường gặp ở các loài động vật đơn giản hoặc một số loài động vật bậc cao trong điều kiện đặc biệt.
b. Phân biệt các hình thức sinh sản vô tính ở động vật và lấy ví dụ:
| Hình thức sinh sản vô tính | Đặc điểm | Ví dụ minh họa |
|---|---|---|
Phân đôi | Cơ thể mẹ tách thành 2 cơ thể con giống nhau. | Trùng roi, trùng amip, trùng giày |
Nảy chồi | Cơ thể con mọc ra từ một chồi trên cơ thể mẹ, sau đó tách ra hoặc sống bám vào mẹ. | Thủy tức, san hô |
Tái sinh | Một phần cơ thể bị mất có thể phát triển thành cá thể mới. | Giun dẹp (planaria), sao biển |

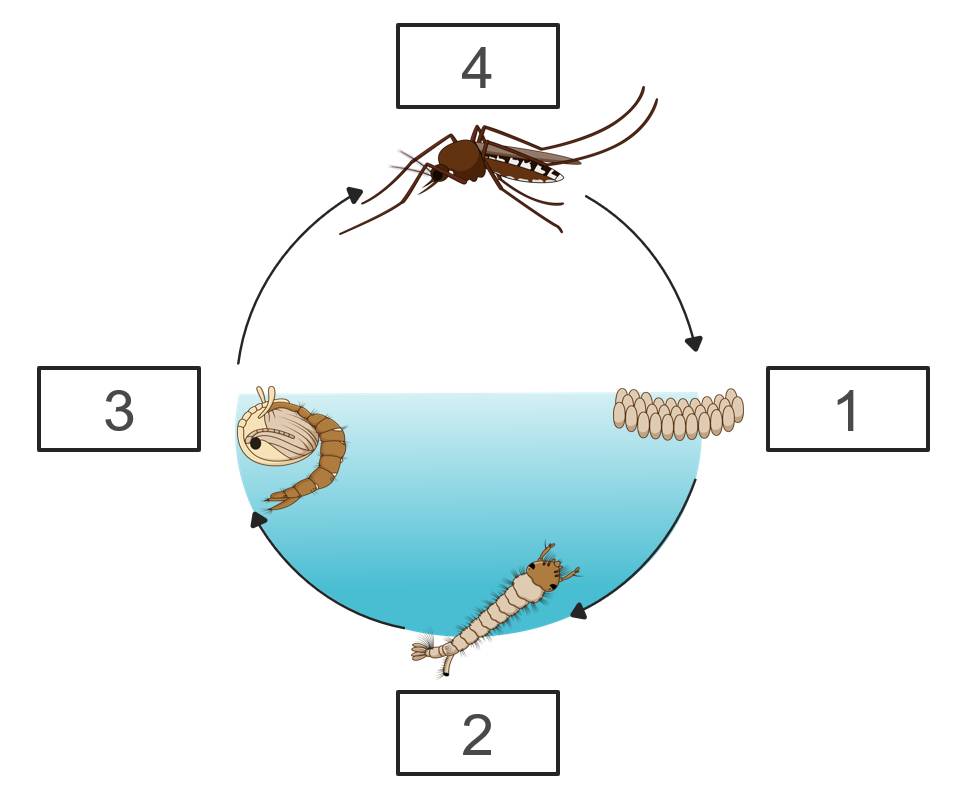
a, Giai đoạn trứng: Muỗi cái đẻ trứng trên mặt nước, thường xếp thành bè.
Giai đoạn ấu trùng (bọ gậy): Trứng nở thành ấu trùng (bọ gậy), sống trong nước, ăn các chất hữu cơ và phát triển.
Giai đoạn nhộng: Ấu trùng lột xác thành nhộng, không ăn nhưng vẫn sống trong nước và chuẩn bị biến đổi thành muỗi trưởng thành.
Giai đoạn muỗi trưởng thành: Nhộng nở thành muỗi trưởng thành, rời khỏi mặt nước để sống trên cạn, bắt đầu chu kỳ sinh sản mới.
b,
-Nên tiêu diệt muỗi ở giai đoạn ấu trùng (bọ gậy) là hiệu quả nhất.
Lý do:
-Dễ kiểm soát: Ấu trùng sống tập trung trong nước (ao, hồ, dụng cụ chứa nước), giúp dễ dàng xử lý bằng cách vệ sinh và loại bỏ môi trường nước đọng.
-Ngăn chặn số lượng lớn: Tiêu diệt ở giai đoạn này sẽ ngăn chặn chúng phát triển thành muỗi trưởng thành, giảm nguy cơ lây truyền bệnh.
-Chi phí thấp: Các biện pháp như thả cá ăn bọ gậy, sử dụng hóa chất hoặc làm sạch môi trường ít tốn kém hơn so với việc phun thuốc diệt muỗi trưởng thành.
-Tiêu diệt muỗi ở giai đoạn trưởng thành cũng hiệu quả nhưng khó khăn hơn do chúng di chuyển nhiều và lây lan nhanh.

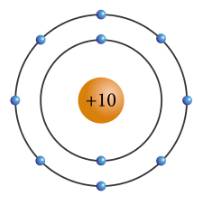
a: X có 10electron và có 2 lớp electron
b: X là neon
c: Oxy, Nitơ,cacbon

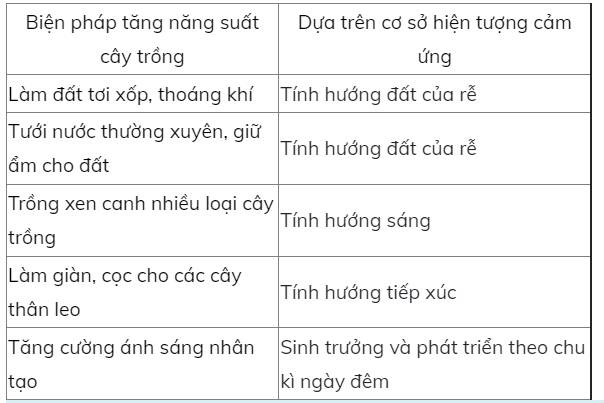
mô phân sinh đỉnh:giúp cho cây cao lên
mô phân sinh bên:giúp cho cây to hơn
vai trò:giúp cho cây phát triển tốt

Ưu điểm của mang thai và sinh con ở thú so với đẻ trứng ở các động vật khác: Phôi được nuôi dưỡng và bảo vệ tốt, chất dinh dưỡng từ cơ thể mẹ qua nhau thai để nuôi thai rất phong phú, nhiệt độ trong cơ thể mẹ rất thích hợp cho sự phát triển của phôi.