Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

a, \(Fe_2O_3+3H_2\underrightarrow{t^o}2Fe+3H_2O\)
b, \(n_{Fe_2O_3}=\dfrac{24}{160}=0,15\left(mol\right)\)
Theo PT: \(n_{H_2}=3n_{Fe_2O_3}=0,45\left(mol\right)\)
\(\Rightarrow V_{H_2}=0,45.22,4=10,08\left(l\right)\)
c, n\(n_{Fe}=2n_{Fe_2O_3}=0,3\left(mol\right)\)
PT: \(Fe+2HCl\rightarrow FeCl_2+H_2\)
Theo PT: \(n_{HCl}=2n_{Fe}=0,6\left(mol\right)\Rightarrow V_{HCl}=\dfrac{0,6}{1,5}=0,4\left(M\right)\)

\(n_{Fe_3O_4}=\dfrac{24}{232}=\dfrac{3}{29}\left(mol\right)\)
PTHH :
\(Fe_3O_4+4H_2\underrightarrow{t^o}3Fe+4H_2O\)
3/29 9/29
\(Fe+2HCl\rightarrow FeCl_2+H_2\uparrow\)
9/29 18/29
\(c,V_{HCl}=\dfrac{\dfrac{18}{29}}{1,5}=\dfrac{12}{29}\left(l\right)\)

Mình thay trên câu a luôn nhé.
5. Số mol của Fe là :
nFe = 5,6/56 = 0,1 (mol)
a) Ta có PTHH :
Fe + 2HCl \(\rightarrow\) FeCl2 + H2\(\uparrow\)
1 mol 2 mol 1 mol 1 mol
0,1 mol 0,2 mol 0,1 mol 0,1 mol
Số mol của Fe là :
nFe = 5,6/56 = 0,1 (mol)
b) Khối lượng của FeCl2 tạo thành sau p.ứng là :
mFeCl2 = 0,1.127 = 12,7 (g)
c) Thể tích khí Hiđro (đktc) tạo thành sau p.ứng là :
VH2 = 0,1.22,4 = 2,24 (l)
4. Công thức của B là : NaxCyOz
+ \(m_{Na}=\frac{106.43,6}{100}\approx46\left(g\right)\)
\(m_C=\frac{106.11,3}{100}\approx12\left(g\right)\)
\(m_O=\frac{106.45,3}{100}\approx48\left(g\right)\)
+ \(n_{Na}=\frac{46}{23}=2\left(mol\right)\)
\(n_C=\frac{12}{12}=1\left(mol\right)\)
\(n_O=\frac{48}{16}=3\left(mol\right)\)
Suy ra trong một p.tử h/c có 2 n.tử Na, 1 n.tử C và 3 n.tử O.
\(\Rightarrow\) CTHH của hợp chất B là Na2CO3.

\(n_{Mg}=\dfrac{4,8}{24}=0,2\left(mol\right)\\ pthh:Mg+2HCl\rightarrow MgCl_2+H_2\)
0,2 0,4 0,2
\(\Rightarrow m_{HCl}=0,4.36,5=14,6\left(g\right)\\ V_{H_2}=0,2.22,4=4,48\left(l\right)\\ pthh:FeO+H_2\underrightarrow{t^o}Fe+H_2O\)
0,2 0,2 0,2
\(m_{Fe}=0,2.56=11,2\left(g\right)\)

$n_{Fe}=\dfrac{2,24}{56}=0,04(mol)$
$a,PTHH:Fe+2HCl\to FeCl_2+H_2$
$b,$ Theo PT: $n_{H_2}=n_{Fe}=0,04(mol)$
$\Rightarrow V_{H_2}=0,04.22,4=0,896(l)$

\(n_{Fe}=\dfrac{28}{56}=0,5mol\)
a, PTHH : \(Fe + 2HCl-> FECl_2+ H_2↑\)
0,5 0,5 0,5 (mol)
b/. Theo phương trình, ta có:
\(n_{FeCl_2}=n_{Fe}=0,5 mol\)
\(m_{FeCl_2}=0,5.127=63,5g\)
c, Thông cảm không biết làm
\(a,PTHH\left(1\right):Fe+2HCl\rightarrow FeCl_2+H_2\uparrow\)
\(b,n_{Fe}=\dfrac{m}{M}=\dfrac{28}{56}=0,5\left(mol\right)\\ Theo.PTHH\left(1\right):n_{FeCl_2}=n_{Fe}=0,5\left(mol\right)\\ m_{FeCl_2}=n.M=0,5.91,5=45,75\left(g\right)\)
\(c,PTHH\left(2\right):2Mg+O_2\underrightarrow{t^o}2MgO\\ n_{Mg}=\dfrac{m}{M}=\dfrac{4,8}{24}=0,2\left(mol\right)\\ Theo.PTHH\left(2\right):n_{O_2}=2.n_{Mg}=0,2.2=0,4\left(mol\right)\\ V_{O_2\left(đktc\right)}=n.22,4=0,4.22,4=8,96\left(l\right)\)
(c lỗi đề à có oxi chứ ko có hidro nên mik thay bằng oxi nha)

a) Gọi số mol H2 phản ứng là a (mol)
PTHH: Fe2O3 + 3H2 --to--> 2Fe + 3H2O
mgiảm = mO(mất đi) = 4,8 (g)
=> nO(mất đi) = \(\dfrac{4,8}{16}=0,3\left(mol\right)\)
=> \(n_{H_2O}=0,3\left(mol\right)\)
=> \(n_{H_2}=0,3\left(mol\right)\)
=> \(V_{H_2}=0,3.22,4=6,72\left(l\right)\)
b) \(n_{Fe}=0,2\left(mol\right)\)
=> \(m_{Fe}=0,2.56=11,2\left(g\right)\)
\(n_{Fe_2O_3}=0,1\left(mol\right)\)
=> \(m_{Fe_2O_3}=0,1.160=16\left(g\right)\)

\(n_{Fe}=\dfrac{5,6}{56}=0,1\left(mol\right)\)
PTHH :
\(Fe+2HCl\rightarrow FeCl_2+H_2\uparrow\)
0,1 0,2 0,1 0,1
\(a,V_{H_2}=0,1.22,4=2,24\left(l\right)\)
\(b,V_{HCl}=\dfrac{n}{C_M}=\dfrac{0,2}{1}=0,2\left(l\right)\)
\(c,m_{FeCl_2}=0,1.127=12,7\left(g\right)\)
Tên gọi : Sắt (II) Clorua
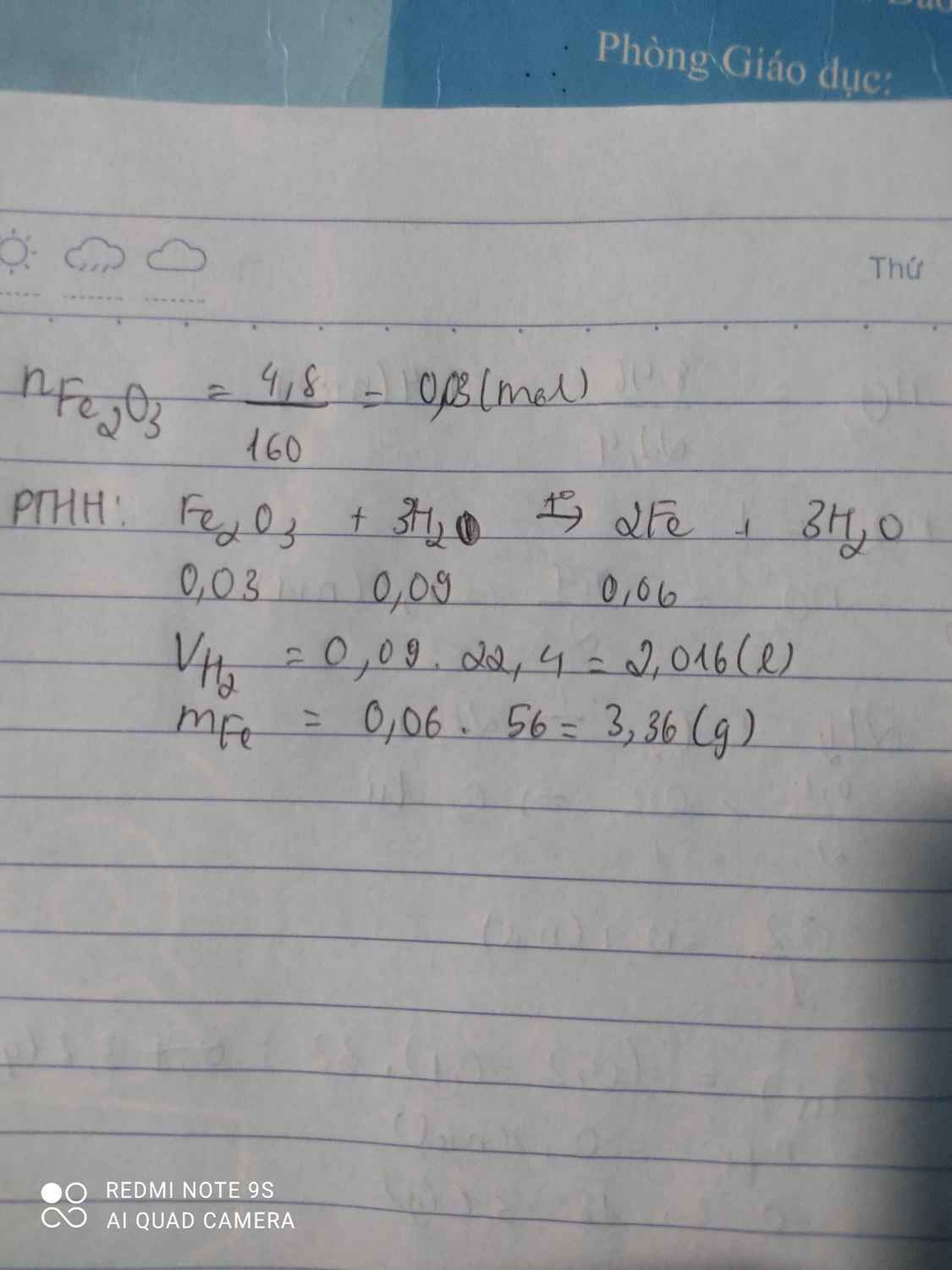
Câu 3:
c, Từ phần trên, có nH2 = nFe = 0,1 (mol)
\(n_{Fe_2O_3}=\dfrac{16}{160}=0,1\left(mol\right)\)
\(Fe_2O_3+3H_2\underrightarrow{t^o}2Fe+3H_2O\)
Xét tỉ lệ: \(\dfrac{0,1}{1}>\dfrac{0,1}{3}\), ta được Fe2O3 dư.
Theo PT: \(n_{Fe}=\dfrac{2}{3}n_{H_2}=\dfrac{1}{15}\left(mol\right)\Rightarrow m_{Fe}=\dfrac{1}{15}.56=\dfrac{56}{15}\left(g\right)\)
a) \(n_{Fe}=\dfrac{5,6}{56}=0,1\left(mol\right)\)
PTHH: `Fe + 2HCl -> FeCl_2 + H_2`
0,1-->0,2----->0,1------>0,1
`=> m_{FeCl_2} = 0,1.127 = 12,7 (g)`
b) `V_{H_2} = 0,1.22,4 = 2,24 (l)`
c) `n_{Fe_2O_3} = (16)/(160) = 0,1 (mol)`
PTHH: \(Fe_2O_3+3H_2\xrightarrow[]{t^o}2Fe+3H_2O\)
Xét tỉ lệ: \(0,1>\dfrac{0,1}{3}\Rightarrow\) Fe2O3
Theo PT: \(n_{Fe}=\dfrac{2}{3}.n_{H_2}=\dfrac{1}{15}\left(mol\right)\)
\(\Rightarrow m_{Fe}=\dfrac{1}{15}.56=\dfrac{56}{15}\left(g\right)\)