Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

\(n_{hh.khí}=\dfrac{2,8}{22,4}=0,125\left(mol\right)\\ n_{Br_2}=\dfrac{4}{160}=0,025\left(mol\right)\\ C_2H_4+Br_2\rightarrow C_2H_4Br_2\)
Khí metan không tác dụng với dd Br2
\(n_{C_2H_4}=n_{Br_2}=0,025\left(mol\right)\)
Vì số mol tỉ lệ thuận với thể tích. Nên:
\(\%V_{C_2H_4}=\%n_{C_2H_4}=\dfrac{0,025}{0,125}.100=20\%\\ \Rightarrow\%V_{CH_4}=100\%-20\%=80\%\)
Vậy chọn D
Chúc em học tốt và có được POP!
\(C_2H_4+Br_2\rightarrow C_2H_4Br_2\)
\(n_{Br_2}=\dfrac{4}{160}=0,025mol\)
\(V_{Br_2}=0,025.22,4=0,56l\)
\(\%V_{C_2H_4}=\dfrac{0,56.100}{2,8}=20\%\)

Ta có: mC2H4 = m bình tăng = 2,8 (g)
\(\left\{{}\begin{matrix}\%m_{C_2H_4}=\dfrac{2,8}{4}.100\%=70\%\\\%m_{CH_4}=30\%\text{ }\end{matrix}\right.\)
Bạn tham khảo nhé!

\(m_{Br_2}=80g\Rightarrow n_{Br_2}=0,5mol\)
\(C_2H_4+Br_2\rightarrow C_2H_4Br_2\)
0,5 0,5
\(n_{hh}=\dfrac{28}{22,4}=1,25mol\)
\(\Rightarrow n_{CH_4}=1,25-0,5=0,75mol\)
\(\%V_{CH_4}=\dfrac{0,75}{1,25}\cdot100\%=60\%\)
\(\%V_{C_2H_4}=100\%-60\%=40\%\)

\(n_{Br_2}=\dfrac{4}{160}=0,025\left(mol\right);n_{hh}=\dfrac{2,8}{22,4}=0,125\left(mol\right)\)
PTHH: \(C_2H_4+Br_2\rightarrow C_2H_4Br_2\)
0,025<-0,125
\(\Rightarrow\left\{{}\begin{matrix}\%V_{C_2H_4}=\dfrac{0,025}{0,125}.100\%=20\%\\\%V_{CH_4}=100\%-20\%=80\%\end{matrix}\right.\)

nBr2 = 32/160 = 0,2 (mol)
PTHH: C2H4 + Br2 -> C2H4Br2
Mol: 0,2 <--- 0,2
nhh khí = 44,8/22,4 = 2 (mol)
%VC2H4 = 0,2/2 = 10%
%VCH4 = 100% - 10% = 90%

nBr2 = 0,125 mol
Khi đốt cháy nA = 0,25 mol
mNaOH ban đầu = 36g => nNaOH = 0,9 mol
Gọi x, y lần lượt là số mol của CO2 và H2O
mdd = 180 + 44x + 18y
Vì NaOH dư do đó chỉ tạo muối trung hòa
CO2 +2NaOH → Na2CO3 + H2O
x 2x
nNaOH dư = 0,9 – 2x
có 2 , 75 % = 40 ( 0 , 9 - 2 x ) 180 + 44 x + 18 y . 100 % (1)
=> 81,21x + 0,495y = 31,05n
2,8 lít khí A tác dụng với 0,125 mol Br2
=> 5,6 lít khí A tác dụng với 0,25 mol Br2
Gọi số mol khí của CH4, C2H4 và C2H2 lần lượt là a; b; c
Ta có a + b + c = 0,25 mol
Và b + 2c = 0,25
=> a = c
=> khi đốt cháy hỗn hợp A cho nCO2 = nH2O
Thay vào (1) => x = y = 0,38 mol
Bảo toàn C, H khi đốt cháy ta có
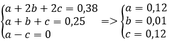
=> %VCH4 = %VC2H2 = 48%
%VC2H4 = 4%

n Br2=\(\dfrac{32}{160}\)=0,2 mol
C2H2+2Br2->C2H2Br4
0,1------0,2 mol
=>%VC2H2=\(\dfrac{0,1.22,4}{5,6}\).100=40%
=>%VCH4=100-40=60%
=>n CH4=\(\dfrac{5,6-0,1.22,4}{22,4}\)=0,15 mol
CH4+2O2-to>CO2+2H2O
0,15----0,3
C2H2+\(\dfrac{5}{2}\)O2-to>2CO2+H2O
0,1-----0,25 mol
=>VO2=(0,3+0,25).22,4=12,32l

a, PT: \(C_2H_4+Br_2\rightarrow C_2H_4Br_2\)
b, - Khí thoát ra là CH4.
⇒ VCH4 = 4,48 (l)
\(\Rightarrow\left\{{}\begin{matrix}\%V_{CH_4}=\dfrac{4,48}{11,2}.100\%=40\%\\\%V_{C_2H_4}=100-40=60\%\end{matrix}\right.\)
\(n_{hh}=\dfrac{2,8}{22,4}=0,125mol\)
\(n_{Br_2}=\dfrac{4}{160}=0,025mol\)
\(n_{Br_2}=n_{C_2H_4}=0,025mol\)
\(\%V_{C_2H_4}=\dfrac{0,025}{0,125}.100=20\%\)
\(V_{CH_4}=100\%-20\%=80\%\)
=> Chọn D
D