Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

a) Khối lượng các nguyên tố có trong A
mC = 12. nCO2 = 12. (8,96: 22,4) = 4,8 gam
mH = 2.nH2O = 2. (10,8 : 18) = 1,2 gam
Ta có: mC + mH = 4,8 +1,2 = 6 (g) = mA
Vậy chất hữu cơ A chỉ có 2 nguyên tố là cacbon và hiđro.
b) Gọi công thức phân tử của A: CxHy
Ta có tỉ lệ: x : y = 0,4 : 1,2 = 1 : 3
⇒ Công thức tổng quát của A: (CH3)n
Biết: dA/H2 = 15 ⇒ MA = 15.2 =30 (g/mol) ⇒ 15n = 30 ⇒ n =2
Vậy, công thức phân tử của hiđrocacbon A là C2H6 (etan)
c) Công thức cấu tạo của A: CH3 - CH3
Chất A không làm mất màu dung dịch brom vì A chỉ có liên kết đơn trong phân tử.
d) Phương trình hóa học : C2H6 + Cl2 → C2H5Cl + HCl

Câu 1 :
Theo đề ta có : nC = nCO2 = \(\dfrac{6,6}{44}=0,15\left(mol\right)\)
nH = 2nH2O = \(\dfrac{2.2,7}{18}=0,3\left(mol\right)\)
Ta có : mC + mH = 0,15.12+0,3 = 2,1(g) < 4,5(g)
=> Trong h/c có chứa O
=> mO = \(4,5-2,1=2,4\left(g\right)\)
=> nO = 0,15(mol)
Đặt CTTQ của hc là CxHyOz
Ta có tỉ lệ : x:y:z = nC : nH : nO = 0,15:0,3:0,15 = 1:2:1
=> CT đơn giản của hc là (CH2O)n
=> n = \(\dfrac{60}{12+2+16}=2\)
Vậy CTPT của h/c là C2H4O2
Câu 2 :
Đặt CTTQ của A là CxHy
Theo đề bài ta có : nH = 2nH2O = \(\dfrac{2.5,4}{18}=0,6\left(mol\right)\) ; nA = 3/30 = 0,1(mol)
=> mC = mA - mH = 3 - 0,6 = 2,4(g)
=> nC = 0,2(mol) => nCO2 = 0,2(mol)
PT cháy :
CxHy + (x-\(\dfrac{y}{4}\))O2 \(-^{t0}->\) xCO2 + \(\dfrac{y}{2}H2O\)
0,1mol..................................0,2mol.....0,3mol
Ta có : \(\dfrac{1}{0,1}=\dfrac{x}{0,2}=>x=2\) ; \(\dfrac{1}{0,1}=\dfrac{y}{0,3.2}=>y=6\)
Vậy CTPT của A là C2H6

Câu 1:
Ta có :
nC=nCO2=8,8/44=0,2 mol
nH=2nH2O=3,6/18=0,4 mol
=> mC+ mH=(0,2.12) + (0,4.1)=2,8g
=> Hợp chất hữu cơ A có 3 nguyên tố : C,H,O
CxHyOz + (x+y/2-z/2)O2--------->xCO2 + y/2H2O
Ta có :
n O2=(6-2,8)/32=0,1 mol
=> n CO2=0,1x=0,2=>x=2
y=2x=>y=4
12x+y+16z=60=>z=2
Vậy A có CT: C2H4O2

câu 1 :
a)
(1) C2H4 + H2O \(^{axit}\rightarrow\)C2H5OH
(2) CH3 - CH2- OH + O2 \(\underrightarrow{men}\)CH3 - COOH + H2O
(3) CH3 - COOH + C2H4 \(\rightarrow\) CH3COOC2H5
b) - cho mẩu KL Na và rượu etylic, ta thấy có bọt khí thoát ra , mẩu Na tan dần
2CH3 - CH2 -OH + Na \(\rightarrow\) 2CH3 - CH2 - ONa + H2

a, mC=8,8.12\44=2,4g
mH=5,4.2\18=0,6g
mO = 3 – 2,4 – 0,6 = 0
Vậy trong A có 2 nguyên tố : C, H
b, A có dạng CxHy
Ta có: x:y=2,4\12:0,6\1=1:3
→ x = 1 ; y = 3
CT tổng quát của A : (CH3)n
Với n = 1 CH3 (loại)
n = 2 → M(CH3)n = (12 + 1.3).2 = 30 < 40 (chọn)
n = 3 → M(CH3)n = (12 + 1.3).3 = 45 > 40 (loại)
Vậy: CTPT của A là : C2H6
c, Khi cho sản phẩm cháy gồm CO2 và H2O vào dung dịch Ca(OH)2 thì có phản ứng.
CO2 + Ca(OH)2 → CaCO3 + H2O
0,2 mol 0,3mol
Khối lượng tính theo CO2 → mCaCO3 = 0,2.100 = 20g

a) Theo đề ra MX = 13,5.2 = 27 =>MB < MX < MA
-MB < 27 =>B là CH4 (M = 16) hoặc C2H2 (M = 26)
-Vì A, B khác dãy đồng đẳng và cùng loại hợp chất nên:
+)Khi B là CH4 ( x mol) thì A là C2H4 (y mol)
CH4 + 2O2-> CO2 + 2H2O
C2H4 + 3O2-> 2CO2 + 2H2O
Từ các pthh và đề ra ta có: mX = 16x + 28y = 3,24
nCO2 = x + 2y = 0,21
Giải pt ta đc: x = 0,15 ; y = 0,03
mCH4 = 0,15 . 16 = 2,4 g ; => %mCH4 =( 2,4.100 ) : 3,24 = 74,07%
=>%mC2H4 = 100% - 74,07% = 25,93%
+) Khi B là C2H2 thì A là C3H6 hoặc C3H8
_Khi A là C3H6: công thức cấu tạo của A là CH3-CH=CH2
PTHH đốt cháy: 2C2H2 + 5O2-> 4CO2 + 2H2O
2C3H6 + 9O2-> 6CO2 + 6H2O
Từ các pthh và đề ra ta có: mX = 26x + 42y = 3,24
nCO2 = 2x + 3y = 0,21
Giải pt ta đc: x = 0,17 ; y = -0,15 => Loại
_Khi A là C3H8: công thức cấu tạo của A là CH3-CH2-CH3
PTHH đốt cháy: 2C2H2 + 5O2-> 4CO2 + 2H2O
C3H8 + 5O2-> 3CO2 + 4H2O
Từ các pthh và đề ra ta có: mX = 26x + 44y = 3,24
nCO2= 2x + 3y = 0,21
Giải pt ta đc: x < 0 => Loại
Vậy B là CH4 và A là C2H4
b) Sơ đồ điều chế CH3COOCH3 từ CH4:
+ CH4 → CH≡CH → CH2=CH2 → C2H5OH → CH3COOCH3
+ CH4 → CH3Cl → CH3OH → CH3COOCH3
*Sơ đồ điều chế CH3COOCH(CH3)2 từ CH4:
+ CH4 → CH≡CH → CH2=CH2 → C2H5OH → CH3COOCH3
+ C2H5OH → CH2 = CH - CH = CH2 → CH3CH2CH2CH3 → CH3CH=CH2 → (CH3)2CHOH → CH3COOCH(CH3)2

\(n_{CO2}=n_C=\frac{8,8}{44}=0,2\left(mol\right)\)
\(n_H=2n_{H2O}=\frac{2.5,4}{18}=0,6\left(mol\right)\)
\(n_C:n_H=0,2:0,6=1:3\)
=> CTĐGN (CH3)n
\(M=30\Rightarrow15n=30\)
\(\Rightarrow n=2\)
Vậy CTPT của a là C2H6

a) Theo đề ta có:
\(d_{A/H2}=15\)
\(\Rightarrow M_A=15.2=30\left(\frac{g}{mol}\right)\)
Khối lượng của các nguyên tố có trong A là:
\(n_C=n_{CO2}=\frac{8,8}{44}=0,2\left(mol\right)\)
\(\Rightarrow m_C=0,2.12=2,4\left(g\right)\)
\(n_{H2}=n_{H2O}=\frac{5,4}{18}=0,3\left(mol\right)\)
\(\Rightarrow m_{H2}=0,3.2=0,6\left(g\right)\)
\(\Rightarrow m_{O2}=m_A-\left(m_C+m_{H2}\right)=3-\left(2,4+0,6\right)=0\)
Đặt CTTQ của A là: CxHy
Ta có tỉ lệ: \(x:y=n_C:2n_{H2}=0,2:0,6=1:3\)
\(\Rightarrow\) CTN của A là: (CH3)n
Mà 15n ≤ 27
\(\Rightarrow n=2\)
Vậy CTPT của A là: C2H6
b) CTCT của A là:
1/ CH3-CH3
c) \(n_{NaOH}=\frac{60}{40}=1,5\left(mol\right)\)
\(PTHH:CO_2+2NaOH\rightarrow Na_2CO_3+H_2O\)
________0,2/1_0,5/1______________
Tỉ lệ: \(\frac{0,2}{1}< \frac{1,5}{2}\Rightarrow\) NaOH dư
\(\Rightarrow C\%_C=\frac{0,2.106}{19+0,75.40}.100\%=43,3\%\)

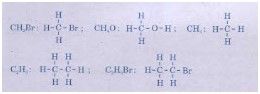
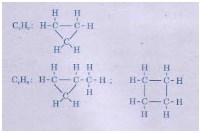
b4
-Đốt cháy A thu CO2 và H2O suy ra A chứa C,H và có thể có thêm O
nC=nCO2=8,8\44=0,2mol→mC=2,4g
nH=2nH2O=2.5,4\18=0,6mol→mH=0,6g
mC+mH=2,4+0,6=3g=mA→→ Vậy A chỉ có C và H
- Ta có: nC:nH=0,2:0,6=1:3
→→Công thức nguyên: (CH3)n
- Theo đề ta có: 15n<40→→n<2,67 Vì n nguyên dương nên n=1 và n=2
- Khi n=1 →→CTPT CH3 không đảm bảo hóa trị của C(C hóa trị IV): loại
- Khi n=2→→CTPT: C2H6(chọn)
b6
C2H4 + Br2==>C2H4Br2
metan(CH4) ko td với brom
b, mol hỗn hợp = 0.15(mol)
Do chỉ có etilen td được với brom nên khí thoát ra là metan
==>mol Ch4=0.1(mol)==>molC2H4=0.05(mol)
%V CH4=66.67%==>%VC2H4=33.33%
CH4+2O2--to->CO2+2H2O
0,1-----0,2
C2H4+3O2-to->2CO2+2H2O
0,05-----0,15
=>Vkk=(0,2+0,15).22,4.5=39,2 l