Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Đặt \(\left\{{}\begin{matrix}n_{Mg}=a\left(mol\right)\\n_{Fe}=b\left(mol\right)\\n_{Zn}=c\left(mol\right)\\n_{Al}=d\left(mol\right)\end{matrix}\right.\) \(\Rightarrow95a+127b+136c+133,5d=40,45\) (1)
Sau p/ứ với Clo, ta được: \(95a+162,5b+136c+133,5d=44\) (2)
Lấy PT (2) trừ PT (1) \(\Rightarrow35,5b=3,55\) \(\Rightarrow b=n_{Fe}=0,1\left(mol\right)\)
\(\Rightarrow\%m_{Fe}=\dfrac{0,1\cdot56}{13,47}\cdot100\%\approx41,57\%\)

Gọi a, b, c là mol Fe, Al, Cr
\(m_{tang}=31,95\left(g\right)=m_{Cl}\Rightarrow n_{Cl}=0,9\left(mol\right)\)
\(\Rightarrow3a+3b+3c=0,9\left(1\right)\)
\(n_{H2}=0,35\left(mol\right)\rightarrow n_{Cl}=n_{HCl}=2n_{H2}=0,7\left(mol\right)\)
\(\Rightarrow2a+3b+2c=0,7\left(2\right)\)
(1) trừ (2) \(\Rightarrow a+c=0,2\)
Nếu a= k thì c= 0,2-k mol
\(\Rightarrow3k+3b+3\left(0,2-k\right)=0,9\)
\(\Leftrightarrow b=0,1\left(mol\right)\)
\(\%n_{Al}=\frac{0,1.100}{0,2+0,1}=66,67\%\)

1.a. Sơ đồ các quá trình phản ứng
Kim loại + Oxi \(\rightarrow\) (hỗn hợp oxit ) + axit \(\rightarrow\) muối + H2O
Từ quá trình trên => số mol H2SO4 phản ứng = số mol oxi trong oxit
Theo bài ta có: moxi = 39,2 – 29,6 = 9,6(g)
=> \(n_O=\frac{9,6}{16}=0,6mol\)
=> số mol H2SO4 phản ứng = 0,6 (mol)
b. Khối lượng muối = khối lượng kim loại + khối lượng gốc sunfat
=> mm = 29,6 + 96. 0,6 = 87,2 (g)
2. Gọi công thức của oxit cần tìm là MxOy
Phương trình phản ứng.
MxOy + yH2 \(\rightarrow\) xM + yH2O (1)
\(n_{H_2}=\frac{985,6}{22,4.1000}=0,044\left(mol\right)\)
Theo định luật bảo toàn khối lượng
=> khối lượng kim loại = 2,552 + 0,044.2 – 0,044.18 = 1,848(g)
Khi M phản ứng với HCl
2M + 2nHCl \(\rightarrow\) 2MCln + nH2 (2)
\(n_{H_2}=\frac{739,2}{22,4.1000}=0,033\left(mol\right)\)
(2) => \(\frac{1,848}{M}.n=2.0,033\)
=> M = 28n
Với n là hóa trị của kim loại M
Chỉ có n = 2 với M = 56 (Fe) là thỏa mãn
Theo (1) \(\frac{x}{y}=\frac{n_M}{n_{H_2}}=\frac{0,033}{0,044}=\frac{3}{4}\)
=> oxit cần tìm là Fe3O4
1.a. Sơ đồ các quá trình phản ứng
Kim loại + Oxi (hỗn hợp oxit ) + axit muối + H2O
Từ quá trình trên => số mol H2SO4 phản ứng = số mol oxi trong oxit
Theo bài ta có: moxi = 39,2 – 29,6 = 9,6(g)
=>
=> số mol H2SO4 phản ứng = 0,6 (mol)
b. Khối lượng muối = khối lượng kim loại + khối lượng gốc sunfat
=> mm = 29,6 + 96. 0,6 = 87,2 (g)
2. Gọi công thức của oxit cần tìm là MxOy
Phương trình phản ứng.
MxOy + yH2 xM + yH2O (1)
Theo định luật bảo toàn khối lượng
=> khối lượng kim loại = 2,552 + 0,044.2 – 0,044.18 = 1,848(g)
Khi M phản ứng với HCl
2M + 2nHCl 2MCln + nH2 (2)
(2) =>
=> M = 28n
Với n là hóa trị của kim loại M
Chỉ có n = 2 với M = 56 (Fe) là thỏa mãn
Theo (1)
=> oxit cần tìm là Fe3O4

nH2 = \(\dfrac{1,568}{22,4}\)= 0,07 (mol)
Gọi a,b,c lần lượt là số mol của Fe,Cr,Al
PTHH:
Fe + 2HCl ----> FeCl2 + H2\(\uparrow\)
a mol------------------->a mol
Cr + 2HCl ----> CrCl2 + H2\(\uparrow\)
b mol--------------------> b mol
2Al + 6HCl ---->2 AlCl3 + 3H2\(\uparrow\)
c mol-----------------------> 1,5c mol
Ta có:
56a + 52b + 27c = 2,7 (1)
a + b + 1,5c = 0,07 (2)
PTHH:
2Fe + 3Cl2 \(\underrightarrow{t^0}\) 2FeCl3
a mol--------> a mol
2Cr + 3Cl2 \(\underrightarrow{t^0}\)2CrCl3
b mol--------> b mol
2Al + 3Cl2 \(\underrightarrow{t^0}\)2AlCl3
c mol-------> c mol
Ta lại có:
162,5a + 158,5b + 133,5c = 9,09 (3)
Từ (1),(2),(3) ta có pt:
\(\left\{{}\begin{matrix}56a+52b+27c=2,7\\a+b+1,5c=0,07\\162,5a+158,5b+133,5c=9,09\end{matrix}\right.\)
=> a = b = c = 0,02
mAl = 0,02 . 27 = 0,54(g)

\(n_{Fe}=a\left(mol\right),n_{Mg}=b\left(mol\right),n_{Al}=c\left(mol\right),n_{Zn}=d\left(mol\right)\)
\(n_{H_2}=\dfrac{2.24}{22.4}=0.1\left(mol\right)\)
\(\)\(BTe:\)
\(2a+2b+3c+2d=0.2\left(1\right)\)
\(n_{Cl_2}=\dfrac{3.36}{22.4}=0.15\left(mol\right)\)
\(BTe:\)
\(3a+2b+3c+2c=0.15\cdot2=0.3\left(2\right)\)
\(\left(2\right)-\left(1\right):a=0.3-0.2=0.1\)
\(\%Fe=\dfrac{0.1\cdot56}{32}\cdot100\%=17.5\%\)

1) Ptpư:
2Al + 6HCl \(\rightarrow\) 2AlCl3 + 3H2
Fe + 2HCl \(\rightarrow\) FeCl2 + H2
Cu + HCl \(\rightarrow\) không phản ứng
=> 0,6 gam chất rắn còn lại chính là Cu:
Gọi x, y lần lượt là số mol Al, Fe
Ta có:
3x + 2y = 2.0,06 = 0,12
27x + 56 y = 2,25 – 0,6 = 1,65
=> x = 0,03 (mol) ; y = 0,015 (mol)
=> \(\%Cu=\frac{0,6}{2,25}.100\%=26,67\%\); \(\%Fe=\frac{56.0,015}{2,25}.100\%=37,33\%\); %Al = 36%
2) \(n_{SO_2}=\frac{1,344}{22,4}=0,06mol\); m (dd KOH) = 13,95.1,147 = 16 (gam)
=> mKOH = 0,28.16 = 4,48 (gam)=> nKOH = 0,08 (mol)=> \(1<\)\(\frac{n_{KOH}}{n_{SO_2}}<2\)
=> tạo ra hỗn hợp 2 muối: KHSO3: 0,04 (mol) và K2SO3: 0,02 (mol)
Khối lượng dung dịch sau pu = 16 + 0,06.64 = 19,84 gam
=> \(C\%\left(KHSO_3\right)=\frac{0,04.120}{19,84}.100\%\)\(=24,19\%\)
\(C\%\left(K_2SO_3\right)=\frac{0,02.158}{19,84}.100\%\)\(=15,93\%\)

Có thể xem công thức Fe3O4 là FeO.Fe2O3 nên hỗn hợp X có thể được xem như gồm FeO và Fe2O3.
Gọi a là số mol FeO, b là số mol Fe2O3 của 0,5 m gam X.
FeO + H2SO4 --->FeSO4 + H2O
Fe2O3 + 3H2SO4 ---> Fe2(SO4)3 + 3H2O
từ khối lượng muối khan ở phần 1, ta có phương trình
152a + 400b = 31,6 gam (1)
Phần 2 khi cho Cl2 vào thì xảy ra pu:
FeSO4 + 0,5 Cl2 ---> 1/3 Fe2(SO4)3 + 1/3 FeCl3
--> khối lượng muối ở phần 2 = 400a/3 + 162,5a/3 + 400b = 33,375 gam
--> 562a + 1200b = 100,125 (2)
Từ (1) và (2) suy ra :
a =0,0502358 mol
b = 0,0599153 mol
--> Khối lượng hỗn hợp X = 2 x (72 x 0,0502358 + 160 x 0,0599153) = 26,712448 gam
a.
Phương trình
+ Khi hòa A bằng axit H2SO4 loãng
FeO + H2SO4 \(\rightarrow\) FeSO4 + H2O (1)
Fe2O3 + 3H2SO4 \(\rightarrow\) Fe2(SO4)3 + 3H2O (2)
Fe3O4 + 4H2SO4 \(\rightarrow\) Fe2(SO4)3 + FeSO4+ 3H2O (3)
Sau phản ứng dung dịch chỉ có 2 muối (x+z)mol FeSO4 và (y+z) mol Fe2(SO4)3
+ Khi sục khí Cl2 vào dung dịch sau phản ứng chỉ có FeSO4 phản ứng
6FeSO4 + 3Cl2 \(\rightarrow\) 2FeCl3 + 2Fe2(SO4)3 (4)
b.
Theo bài ta có hệ phương trình
\(\begin{cases}72x+160y+232z=m\text{/}2\\152\left(x+z\right)+400\left(y+z\right)=31,6\\187,5\left(x+z\right)+400\left(y+z\right)=33,375\end{cases}\)\(\begin{matrix}\left(I\right)\\\left(II\right)\\\left(III\right)\end{matrix}\)
Từ II, III ta có x+z= 0,05; y+z=0,06
Mặt khác từ I ta có m=2.[ 72(x+z) + 160(y+z)]=26,4 gam
Vậy m= 26,4g
\(C_{FeSO_4}\)=0,2M; \(C_{Fe_2\left(SO_4\right)_3}\)=0,24M

Gọi a,b lần lượt là số mol của Al, Fe trong hỗn hợp ban đầu
=> 27a+56b=8,3 (1)
\(n_{H_2}=\dfrac{5,6}{22,4}=0,25mol\)
Ta có quá trình trao đổi elcetron
\(Al^0\rightarrow Al^{+3}+3e\)
a----------------3a--(mol)
\(Fe^0\rightarrow Fe^{+2}+2e\)
b----------------2b--(mol)
\(2H^{-1}+2e\rightarrow H_2^0\)
----------0,5------0,25-(mol)
Áp dụng định luật bảo toàn e ta có: 3a+2b=0,5 (2)
Giải hệ phương trình gồm (1) và (2) ta được: \(\left\{{}\begin{matrix}a=0,1\\b=0,1\end{matrix}\right.\)
\(\left[{}\begin{matrix}m_{Al}=0,1\cdot27=2,7g\\m_{Fe}=0,1\cdot56=5,6g\end{matrix}\right.\)
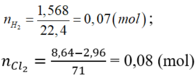
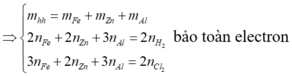
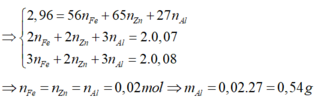
nH2 = 1,56822,41,56822,4= 0,07 (mol)
Gọi a,b,c lần lượt là số mol của Fe,Cr,Al
PTHH:
Fe + 2HCl ----> FeCl2 + H2↑↑
a mol------------------->a mol
Cr + 2HCl ----> CrCl2 + H2↑↑
b mol--------------------> b mol
2Al + 6HCl ---->2 AlCl3 + 3H2↑↑
c mol-----------------------> 1,5c mol
Ta có:
56a + 52b + 27c = 2,7 (1)
a + b + 1,5c = 0,07 (2)
PTHH:
2Fe + 3Cl2 t0→t0→ 2FeCl3
a mol--------> a mol
2Cr + 3Cl2 t0→t0→2CrCl3
b mol--------> b mol
2Al + 3Cl2 to→2AlCl3
c mol-------> c mol
Ta lại có:
162,5a + 158,5b + 133,5c = 9,09 (3)
Từ (1),(2),(3) ta có pt:
56a+52b+27c=2,7
a+b+1,5c=0,07
162,5a+158,5b+133,5c=9,09
=> a = b = c = 0,02
mAl = 0,02 . 27 = 0,54(g)